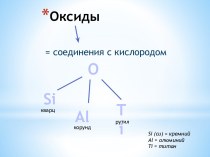
переходных металлах;
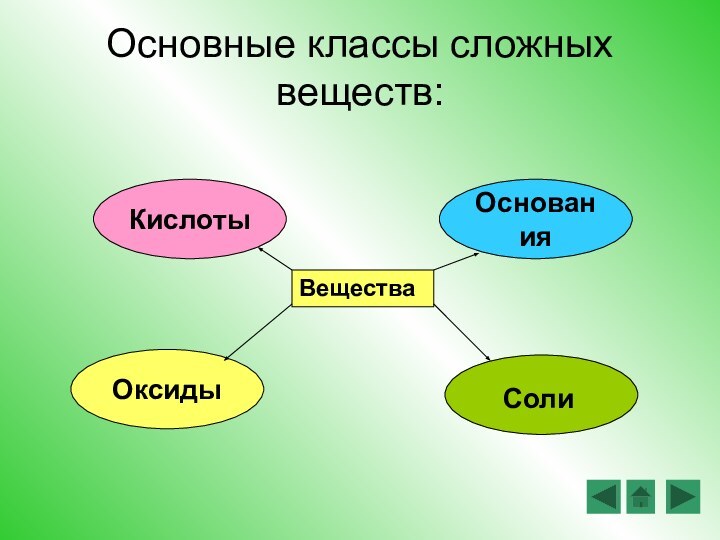
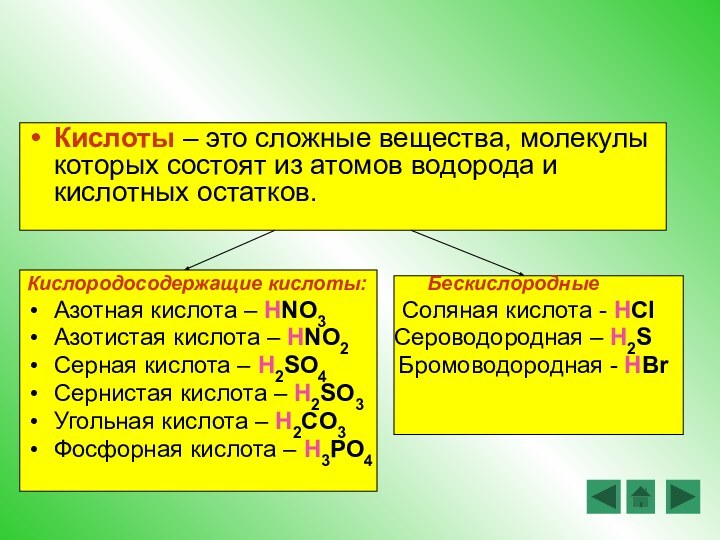
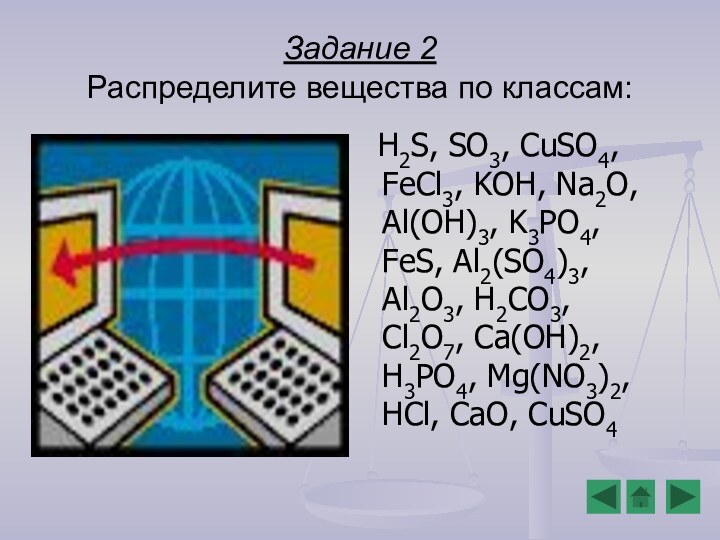
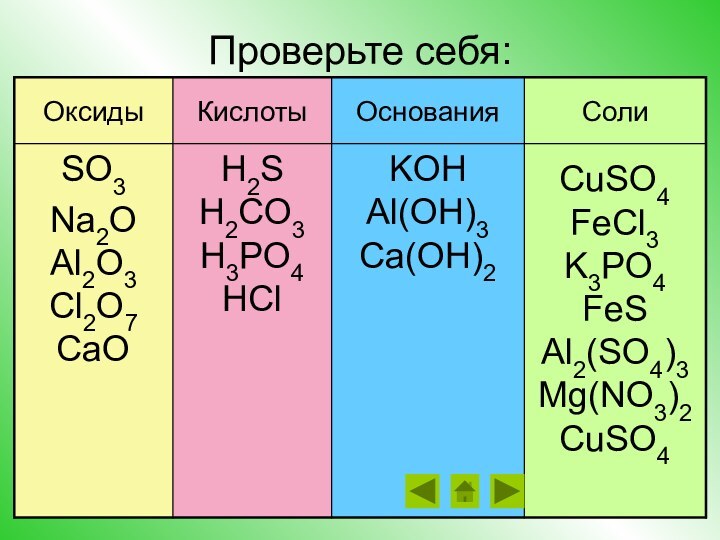
Повторить, закрепить и развить знания о классификации и
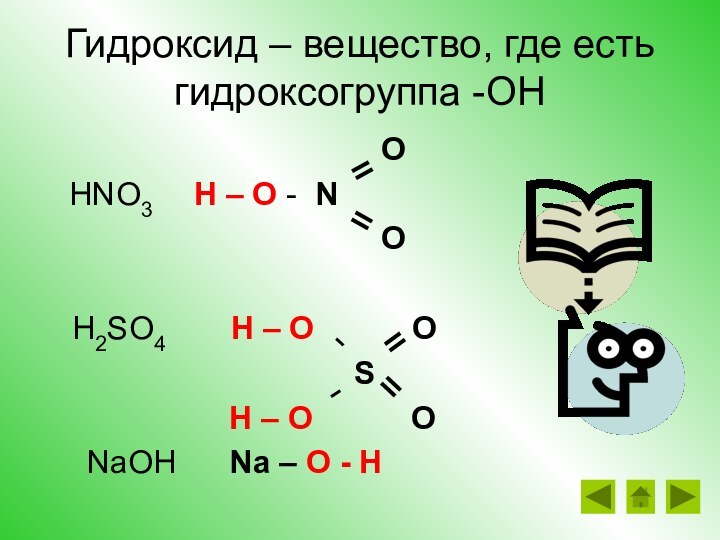
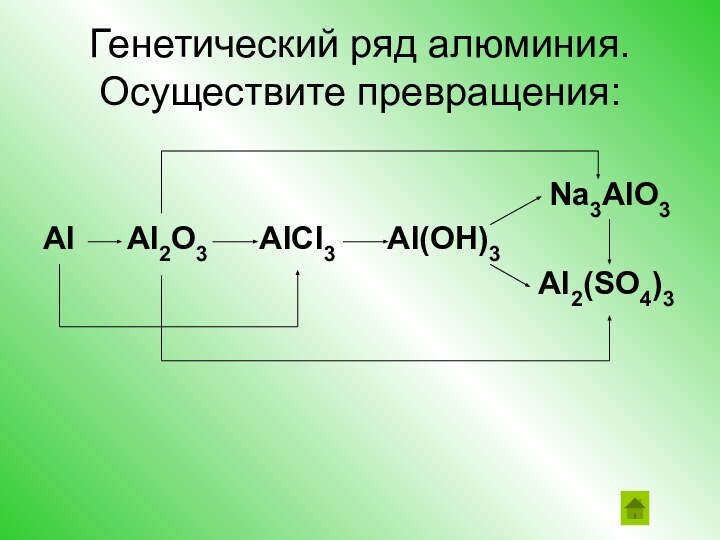
свойствах гидроксидов (в том числе и в свете ТЭД) и о генетической связи между классами веществЦели урока: