Слайд 2
Аминокислоты – это органические соединения, содержащие две функциональные
группы – аминогруппу -NH2 и карбоксильную группу -COOH.
Они
реагируют как с основаниями, так и с кислотами, т.е. они являются амфотерными соединениями
Наличие в молекуле одинакового числа аминогрупп и каббоксильных групп приводит к взаимной внутренней нейтрализации
H H O
H C C C
H NH2 OH
Аминокислоты
Слайд 3
Аминокислоты – бесцветные кристаллические вещества, хорошо растворимые в
воде. Многие из них обладают сладким вкусом.
Реагируют со спиртами,
образуя сложные эфиры.
свойства аминокислот
Слайд 5
Аминокислоты могут реагировать друг с другом: карбоксильная группа
одной аминокислоты реагирует с аминогруппой другой аминокислоты с образованием
пептидной связи и молекулы воды.
NH2 – CH2 – COOH + NH2 – CH2 – COOH =
NH2 – CH2 – CO – NH – CH2 – COOH + H2O
Связь – CO – NH – , соединяющая отдельные аминокислоты в пептид, называется пептидной.
Образование пептидной связи
Слайд 6
СХЕМА ОБРАЗОВАНИЯ ПЕПТИДНОЙ СВЯЗИ
Слайд 7
Аминокислоты необходимы для синтеза белков в живых организмах.
Главными
поставщиками белков
служат мясо, рыба, яйца, творог.
Слайд 8
Белок – это высокомолекулярное органическое соединение, представляющее собой
биополимер, состоящий из мономеров,
которыми являются аминокислоты
соединенные пептидной
связью.
– – NH – CH – CO – NH – CH – CO – NH – CH –
R1 R2 R3
Слайд 9
В состав белка входят химические элементы:
углерод C
водород H2
кислород
O2
азот N
сера S
фосфор P
железо Fe
Молекулярная формула
одного из
белков
Слайд 10
По физическим свойствам белки делятся на :
растворимые в
воде
нерастворимые в воде
Слайд 11
Белки являются компонентами волос
Белки являются компонентами кожи.
Белки являются компонентами мышечной ткани.
Белки являются компонентами крови
белков входят 20 α - аминокислот, но их
остатки могут многократно повторяться в самых различных сочетаниях, поэтому существует огромное число различных белков, каждый из которых имеет свое особенное строение и выполняет свою функцию в жизнедеятельности организма.
Молекула инсулина
Слайд 13
Первичная структура –
это полипептидная
цепь линейной формы
из последовательно
соединенных пептидной
связью (– CO – NH
–)
аминокислот.
– NH – CH – CO – NH – CH – CO – NH – CH –
R1 R2 R3
Структура белка
Слайд 14
Вторичная структура – возникает за счет скручивания первичной
структуры в спираль или в гармошку за счет водородных
связей между соседними витками или звеньями
Слайд 15
Третичная структура – это глобулярная форма, образующаяся за
счет гидрофобных связей между радикалами аминокислот вторичной структуры
Слайд 16
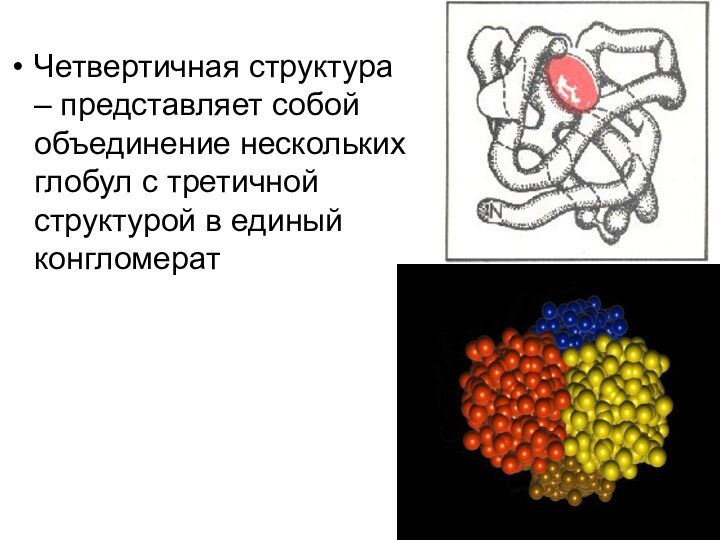
Четвертичная структура – представляет собой объединение нескольких глобул
с третичной структурой в единый конгломерат
Слайд 17
Первичная – образована пептидными связями
Вторичная – образована водородными
связями
Третичная – образована дисульфидными, сложноэфирными, солевыми мостиками
Четвертичная –
гемоглобин (комплекс из четырёх макромолекул)
Слайд 18
химические реакции
цветные (качественные)
денатурация – необратимое
свёртывание белков
гидролиз –
при нагревании
со щелочами или кислотами..
Слайд 19
Иногда небольшие изменения окружающей среды могут вызвать серьезные
изменения в форме белка, что скажется на его функциях.
Слишком сильные изменения окружающей среды могут привести к потере белком его свойств в связи с чрезмерным изменением формы молекулы. Тепло, спирт, различные растворители, соли тяжелых металлов, изменение кислотности вызывают изменение формы белка из-за разрыва связей между цепями. В некоторых случаях изменения в белках необратимы и называются денатурацией.
Разрушение
вторичной структуры
белка при нагревании
Слайд 20
Ксантопротеиновая реакция
В пробирку налейте 2 мл раствора
белка и добавьте по каплям 0,5 мл концентрированного раствора
азотной кислоты. Осторожно нагревайте пробирку и наблюдайте изменение цвета.
РАСТВОР БЕЛКА + HNO3 ?
Жёлтый цвет указывает на присутствие ароматических аминокислот
Биуретовая реакция
К 2–3 мл раствора белка в пробирке добавьте 2–3 мл 10%-го раствора гидроксида натрия. К полученной смеси прилейте 2–3 мл раствора сульфата меди(II). Пробирку встряхните и
РАСТВОР БЕЛКА +NaOH + CuSO4 ?
Красно – фиолетовый окрас указывает на присутствие пептидной группы
РАСТВОР БЕЛКА + СН3СООРb+ NaOH ?
Чёрный цвет указывает на присутствие серы
Слайд 22
Новые понятия:
Гидролиз белков – разрушение первичной структуры белка.
Денатурация
– полное разрушение пространственной структуры белка.
Обратимая денатурация – частичное
разрушение пространственной структуры белка. Обратный процесс называется ренатурация.
Слайд 23
Классификация белков по их функциям
• Структурные белки –
коллаген, склеротин, эластин.
• Каталитические белки – полимеразы, рибонуклеазы.
• Регуляторные
белки – инсулин, глюкагон.
• Транспортные белки – гемоглобин, гемоцианин.
• Защитные белки – антитела, фибриноген.
• Двигательные, или мышечные, белки – миозин, актин.
• Запасательные белки – казеин, альбумин.
• Токсичные белки – змеиный яд, токсины.
• Сигнальные белки – рецепторы.
Слайд 24
Скорость обмена белковых тел
10 дней - 50
% белков печени и
плазмы крови
80 дней - 50 % белков человека
158 дней - белок мышц и кожи человека
Жизнь - 200 раз обновление белков
организма человека
Вообще говоря, старые клетки на новые заменяются очень часто. Например, красные кровяные клетки ежемесячно полностью обновляются. Клетки, выстилающие стенки кишечника, обновляются еженедельно. Каждый раз, принимая ванну, мы сбрасываем с себя мертвые клетки кожи.
Слайд 25
Норма белка в организме человека
Слайд 26
Самостоятельная работа
1. Какие элементы входят в
состав белка?
2. Какие вещества образуются при
гидролизе белков?
3. Опишите физические свойства белков.
4. Какие типы связей наиболее характерны для большинства белковых молекул?
5. Где встречаются белки в природе и каково их значение?
Слайд 27
Ответы:
В состав молекулы белка входят: углерод, водород, кислород,
азот, сера, фосфор, железо.
При гидролизе белка образуются аминокислоты.
Белки
бывают растворимые в воде и не растворимые.
Для большинства белковых молекул характерны типы связи : пептидные, водородные, сложноэфирные, солевые, дисульфидные.
В природе белки встречаются растительного(орехи, масло, жиры, молоко и т.д.) и животного происхождения (яйцо, мясо, рыба) и играют большую роль в биологических процессах живых организмов и людей.
Слайд 28
«Жизнь есть способ существования белковых тел…» (Ф.Энгельс)
Слайд 29
Искусственное получение природных полипептидов возможно. Для этого необходимо
знать, какие аминокислоты входят в состав молекулы, сколько аминокислот
каждого вида в полимерной цепи, в какой последовательности они связаны между собой.
Выдающимся достижением органической химии стал синтез окситоцина. Этот гормон пептидной природы, стимулирующий выделение молока молочными железами, состоит из остатков 9 аминокислот. Выдающемуся американскому биохимику Винсенту Дю Виньо, всю свою жизнь посвятившему изучению гормонов, витаминов и антибиотиков, в 1932 г. удалось установить структуру окситоцина, а в 1954 г. осуществить его полный синтез из отдельных аминокислот. За
эти исследования ему в 1955 г. была присуждена Нобелевская премия
Слайд 30
Более простые пептиды в настоящее время синтезируют химическим
или микробиологическим путем. Например, в качестве синтетического заменителя сахара
в пищевой промышленности широко используется вещество, называемое аспартам. На этикетках с дешевыми газированными напитками он обозначается кодом Е951 (его добавляют также в жевательную резинку).
По химическому
строению
аспартам представляет
собой дипептид,
образованный
аспарагиновой
кислотой и метиловым
эфиром фенилаланина
Слайд 31
Графические формулы и названия
природных -аминокислот