- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Амины. Номенклатура аминов
Содержание
- 2. Кроме того, к аминам относятся азотсодержащие циклы,
- 3. 2.1. Номенклатура аминовВ большинстве случаев названия аминов
- 4. Первичные амины часто называют как производные углеводородов,
- 5. Для смешанных аминов, содержащих алкильные и ароматические
- 6. 2.2. Изомерия аминовСтруктурная изомерия- углеродного скелета, начиная
- 7. изомерия аминогруппы, связанная с изменением степени замещенности
- 8. 2.3. Свойства аминовИзучая новый класс соединений –
- 9. Нуклеофильность - способность частицы предоставить электронную пару
- 10. 2.3.1. Физические свойства аминовСвязь N–H является полярной,
- 11. При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N –
- 12. 2.3.2. Химические свойства аминовАмины имеют сходное с
- 13. 2.3.2.1. Основность аминовДля аминов характерны ярко выраженные
- 14. Связь протона с амином, как и с
- 15. Уменьшение электронной плотности на атоме азота приводит
- 16. На основность аминов влияют различные факторы: электронные
- 17. 2.3.2.2. Окисление аминовАлифатические амины окисляются под действием
- 18. Краситель бензидиновый синий образуется при окислении дифениламина азотной (или
- 19. 2.3.2.3. Взаимодействие с азотистой кислотойАзотистая кислота HNO2 -
- 20. Первичные ароматические амины при комнатной температуре реагируют аналогично,
- 21. 2.4. АнилинАнилин (фениламин) С6H5NH2 – важнейший из ароматических
- 22. С другой стороны, под влиянием аминогруппы бензольное
- 23. Практическое значение имеет реакция анилина с азотистой
- 24. 2.5. Получение аминовВ аминах атом азота находится
- 25. 2.Восстановление амидов (восстановитель - алюмогидрид лития LiAH4): Восстановление нитрилов с образованием
- 26. Скачать презентацию
- 27. Похожие презентации
Кроме того, к аминам относятся азотсодержащие циклы, в которых атом азота связан с углеродными атомами. Например уротропин может рассматриваться как третичный амин. Обычно азотистые (и другие) гетероциклы изучаются в самостоятельном разделе органической химии, поскольку циклическое строение придает некоторые















![Амины. Номенклатура аминов 2.Восстановление амидов (восстановитель - алюмогидрид лития LiAH4): Восстановление нитрилов с образованием первичных аминов:R-C N + 4[H]](/img/tmb/15/1411964/e60f254a1cf81d9247dfa9c0dfc3284d-720x.jpg)

Слайд 3
2.1. Номенклатура аминов
В большинстве случаев названия аминов образуют
из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в
алфавитном порядке.CH3-CH2-NH-CH3 Метилэтиламин
При наличии одинаковых радикалов используют приставки ди и три.
(CH3)2NH Диметиламин
Слайд 4
Первичные амины часто называют как производные углеводородов, в
молекулах которых один или несколько атомов водорода замещены на
аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи.Например:CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
Для аминов, содержащих две группы -NH2, соединенных с неразветвленной углеродной цепью или с циклом, используется название двухвалентного углеводородного радикала и суффикс диамин:
H2N-CH2-CH2-CH2-CH2-NH2 тетраметилендиамин
Слайд 5
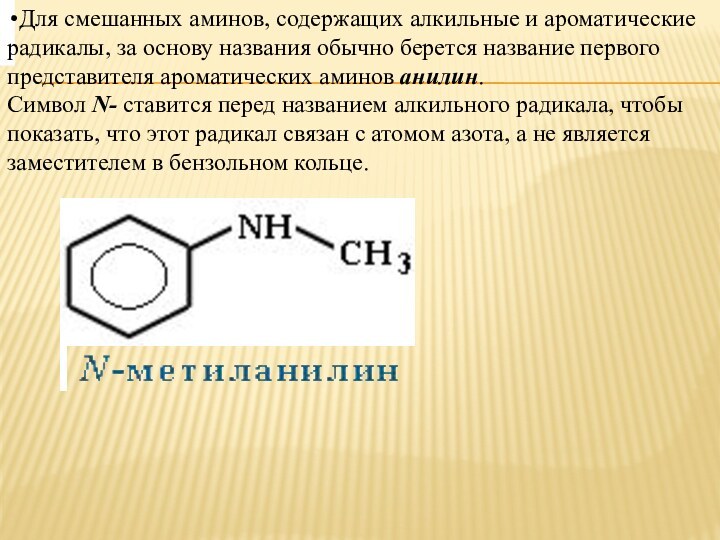
Для смешанных аминов, содержащих алкильные и ароматические радикалы,
за основу названия обычно берется название первого представителя ароматических
аминов анилин.Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце.
Слайд 6
2.2. Изомерия аминов
Структурная изомерия
- углеродного скелета, начиная с
С4H9NH2:
- положения аминогруппы, начиная с
С3H7NH2:Слайд 7 изомерия аминогруппы, связанная с изменением степени замещенности атомов
водорода при азоте, т.е. между типами аминов:
Пространственная изомерия
Возможна оптическая
изомерия, начиная с С4H9NH2:
Слайд 8
2.3. Свойства аминов
Изучая новый класс соединений – амины,
попробуем предсказать их основные физические и химические свойства. Для
этого следует рассмотреть следующие факторы: - характер химических связей; - преимущественный тип разрыва связей; - реакционные центры молекулы; - характер взаимного влияния атомов на реакционную способность отдельных реакционных центров; - возможность межмолекулярных взаимодействий (диполь-дипольных, Н-связей и т.п.).В аминах имеются связи С–Н и С–C , а также связи N–H и N–C. Связи азота с углеродом или водородом – полярные ковалентные. Разрыв полярных связей, как известно, происходит преимущественно гетеролитически. Следовательно, для реакций с участием этих связей характерен ионный механизм. Исходя из распределения электронной плотности в молекуле и наличия неподеленной пары электронов на азоте, можно считать, что амины обладают основными и нуклеофильными свойствами:
Слайд 9
Нуклеофильность - способность частицы предоставить электронную пару на
образование связи с углеродом или с другим положительно заряженным
атомом, кроме протона (H+). Стремление отдать пару электронов протону называется основностью.Кроме того, атом азота в аминах имеет самую низкую для этого элемента степень окисления (-3). Поэтому амины могут вступать в реакции окисления по связям C–N и N–H, проявляя восстановительные свойства.
Слайд 10
2.3.1. Физические свойства аминов
Связь N–H является полярной, поэтому
первичные и вторичные амины образуют межмолекулярные водородные связи (несколько
более слабые, чем Н-связи с участием группы О–Н).Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, а н-гексиламин – при 133 °С).
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения (т. кип. метиламина -6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность водородных связей с атомом азота меньше, чем с участием более электроотрицательного кислорода.
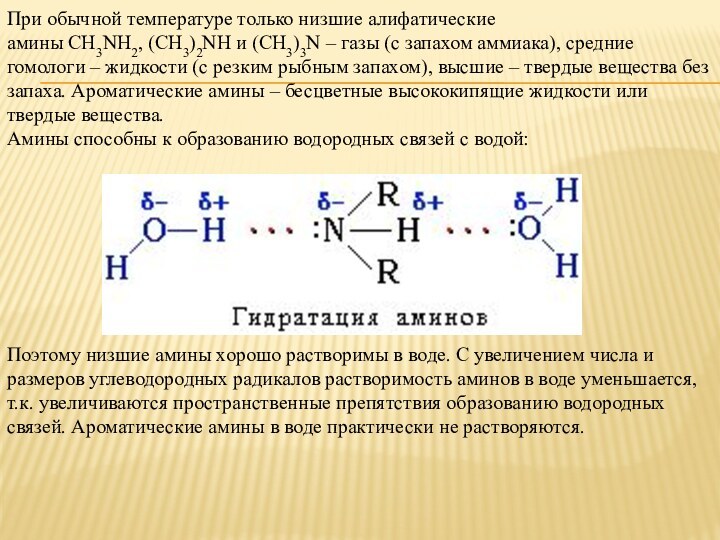
Слайд 11 При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы
(с запахом аммиака), средние гомологи – жидкости (с резким
рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.Амины способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины в воде практически не растворяются.
Слайд 12
2.3.2. Химические свойства аминов
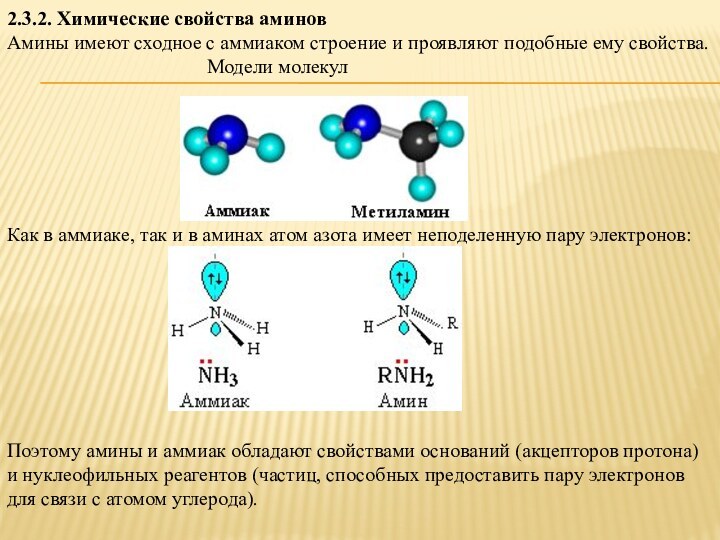
Амины имеют сходное с аммиаком
строение и проявляют подобные ему свойства.
Модели молекулКак в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
Поэтому амины и аммиак обладают свойствами оснований (акцепторов протона) и нуклеофильных реагентов (частиц, способных предоставить пару электронов для связи с атомом углерода).
Слайд 13
2.3.2.1. Основность аминов
Для аминов характерны ярко выраженные основные
свойства (за что их часто называют органическими основаниями).
1. Водные
растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
Слайд 14
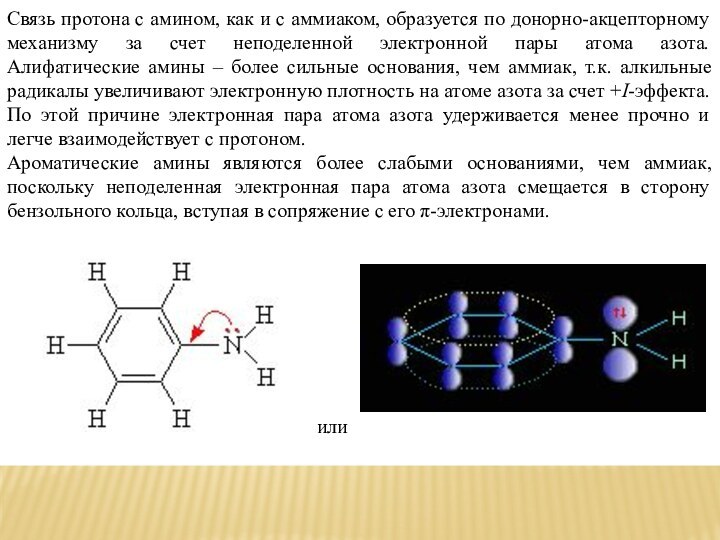
Связь протона с амином, как и с аммиаком,
образуется по донорно-акцепторному механизму за счет неподеленной электронной пары
атома азота. Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его π-электронами.
или
Слайд 15 Уменьшение электронной плотности на атоме азота приводит к
снижению способности отщеплять протоны от слабых кислот. Поэтому анилин
взаимодействует лишь с сильными кислотами (HCl, H2SO4) и, в отличие от алифатических аминов и аммиака, не образует с водой гидроксида.2. Взаимодействуя с кислотами, амины образуют соли:
Соли аминов – твердые вещества, хорошо растворимые в воде. Щелочи (более сильные основания) легко вытесняют из них амины:
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.
Слайд 16 На основность аминов влияют различные факторы: электронные эффекты
углеводородных радикалов, пространственное экранирование радикалами атома азота, а также
способность образующихся ионов к стабилизации за счет сольватации в среде растворителя. В результате+I-эффекта алкильных групп основность алифатических аминов в газовой фазе (без растворителя) растет в ряду:первичные < вторичные < третичные. Однако в растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов. Основность ароматических аминов зависит также от характера заместителей в бензольном кольце. Электроноакцепторные заместители(-F, -Cl, -NO2 и т.п.) уменьшают основные свойства ариламина по сравнению с анилином, а электронодонорные (алкил, -OCH3,-N(CH3)2 и др.), напротив, увеличивают.Основность простейших аминов (в растворе) возрастает в ряду:
C6H5NH2 < NH3 < (CH3)3N < CH3NH2 < (CH3)2NH
Слайд 17
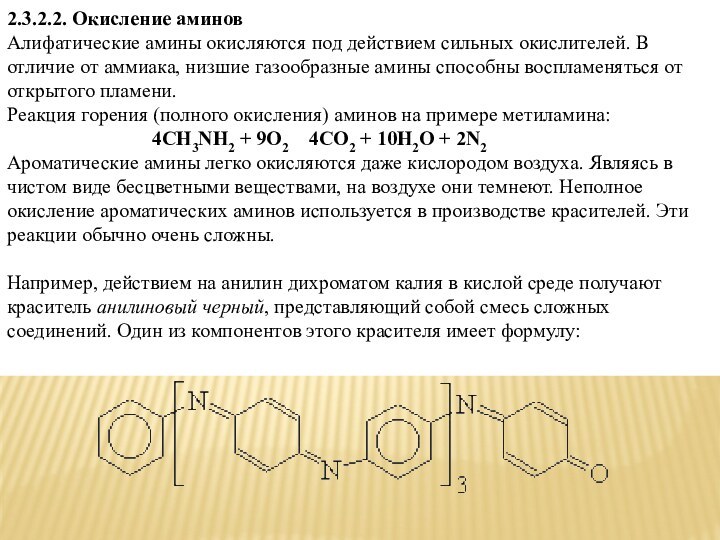
2.3.2.2. Окисление аминов
Алифатические амины окисляются под действием сильных
окислителей. В отличие от аммиака, низшие газообразные амины способны
воспламеняться от открытого пламени. Реакция горения (полного окисления) аминов на примере метиламина:4СH3NH2 + 9O2 4CO2 + 10H2O + 2N2
Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны.
Например, действием на анилин дихроматом калия в кислой среде получают краситель анилиновый черный, представляющий собой смесь сложных соединений. Один из компонентов этого красителя имеет формулу:
Слайд 18
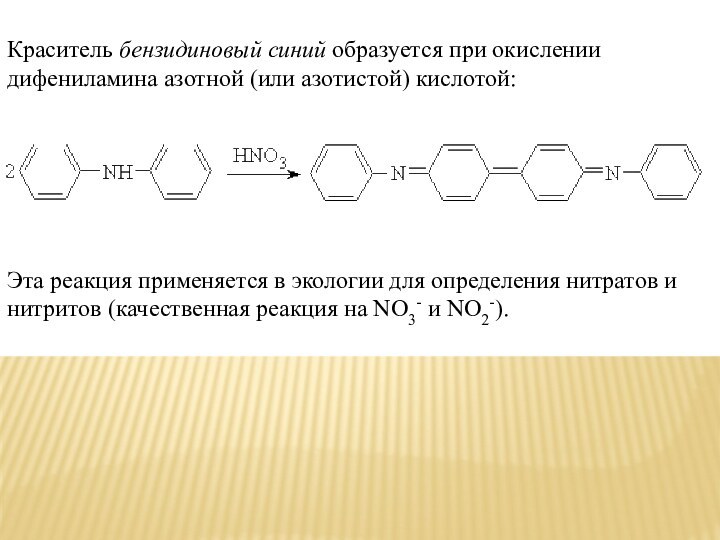
Краситель бензидиновый синий образуется при окислении дифениламина азотной (или азотистой)
кислотой:
Эта реакция применяется в экологии для определения нитратов
и нитритов (качественная реакция на NO3- и NO2-).
Слайд 19
2.3.2.3. Взаимодействие с азотистой кислотой
Азотистая кислота HNO2 - неустойчивое
соединение. Поэтому она используется только в момент выделения. Образуется
HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой:KNO2 + HCl НNO2 + KCl
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов. Важное практическое значение имеет реакция азотистой кислоты с первичными ароматическими аминами .
Первичные алифатические амины c HNO2 образуют спирты. Характерным признаком реакции является выделение азота (дезаминирование аминов):
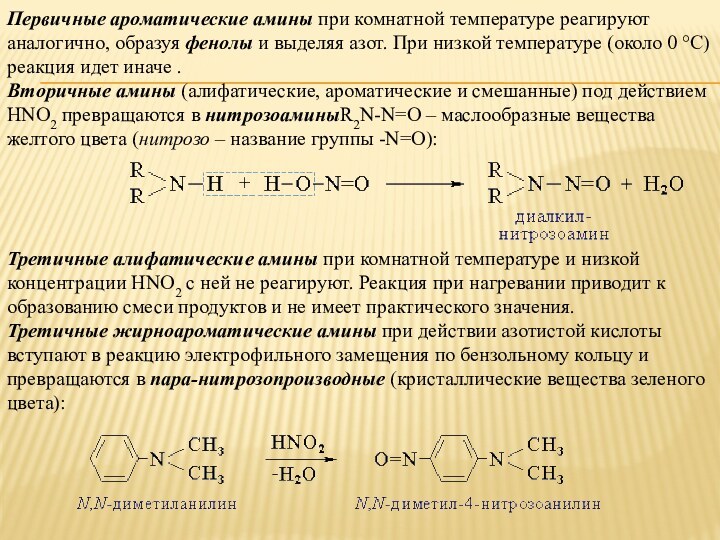
Слайд 20 Первичные ароматические амины при комнатной температуре реагируют аналогично, образуя фенолы и
выделяя азот. При низкой температуре (около 0 °С) реакция идет
иначе .Вторичные амины (алифатические, ароматические и смешанные) под действием HNO2 превращаются в нитрозоаминыR2N-N=O – маслообразные вещества желтого цвета (нитрозо – название группы -N=O):
Третичные алифатические амины при комнатной температуре и низкой концентрации HNO2 с ней не реагируют. Реакция при нагревании приводит к образованию смеси продуктов и не имеет практического значения.
Третичные жирноароматические амины при действии азотистой кислоты вступают в реакцию электрофильного замещения по бензольному кольцу и превращаются в пара-нитрозопроизводные (кристаллические вещества зеленого цвета):
Слайд 21
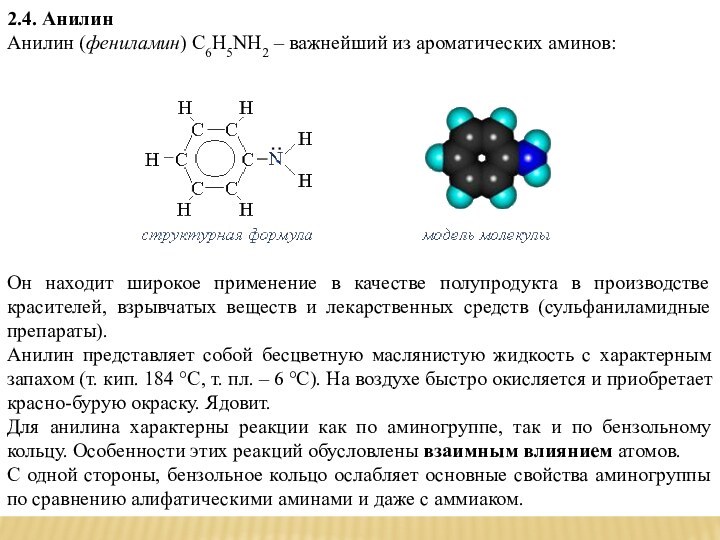
2.4. Анилин
Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов:
Он находит широкое применение в качестве полупродукта в производстве
красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов.
С одной стороны, бензольное кольцо ослабляет основные свойства аминогруппы по сравнению алифатическими аминами и даже с аммиаком.
Слайд 22
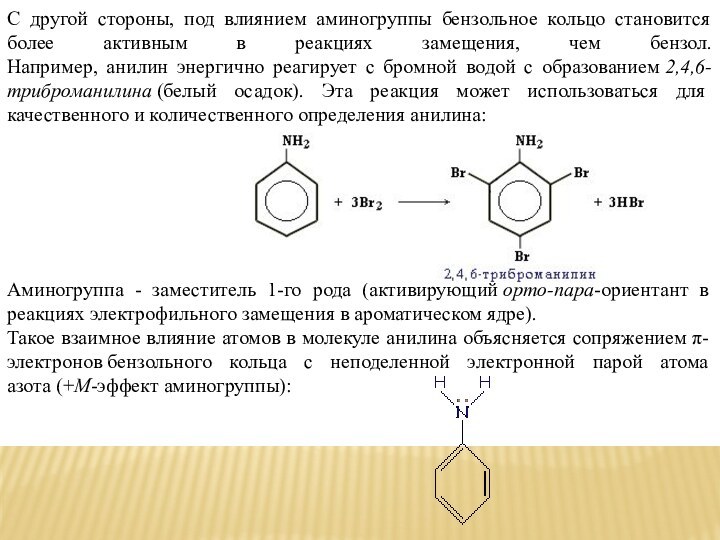
С другой стороны, под влиянием аминогруппы бензольное кольцо
становится более активным в реакциях замещения, чем бензол. Например, анилин
энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок). Эта реакция может использоваться для качественного и количественного определения анилина:Аминогруппа - заместитель 1-го рода (активирующий орто-пара-ориентант в реакциях электрофильного замещения в ароматическом ядре).
Такое взаимное влияние атомов в молекуле анилина объясняется сопряжением π-электронов бензольного кольца с неподеленной электронной парой атома азота (+M-эффект аминогруппы):
Слайд 23 Практическое значение имеет реакция анилина с азотистой кислотой
при пониженной температуре (около 0 °С). В результате этой реакции
(реакции диазотирования) образуются соли диазония (арилдиазониевые соли), которые используются в синтезе азокрасителей и ряда других соединений.При более высокой температуре реакция идет с выделением азота и анилин превращается в фенол:
Подобно анилину реагируют с азотистой кислотой и другие первичные ароматические амины.
Слайд 24
2.5. Получение аминов
В аминах атом азота находится в
низшей степени окисления, поэтому многие способы их получения основаны
на процессах восстановления азотсодержащих соединений других классов (нитропроизводных углеводородов, амидов, нитрилов).Наиболее общим методом получения первичных аминов является восстановление нитросоединений:
Важнейший ароматический амин - анилин - образуется при восстановлении нитробензола (восстановители - водород в присутствии металлических катализаторов, Fe + HCl, сульфиды):
Эта реакция носит имя русского химика Н.Н. Зинина, осуществившего ее впервые в 1842 г.
Восстановление амидов (восстановитель - алюмогидрид лития LiAH4):