структурная
формула
. .
H : N : H
. .
H
электронная формула
Тип химической связи: ковалентная полярная
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть

















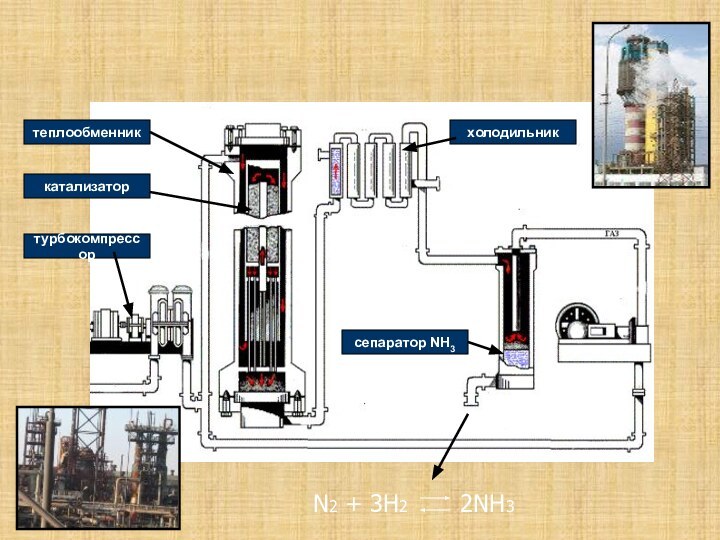









. .
H : N : H
. .
H
электронная формула
Тип химической связи: ковалентная полярная
К чему приводит появление этой связи?
- Происходит повышение температуры плавления и кипения веществ.
Связь очень слабая ( в 15-20 раз слабее
ковалентной)
6
12
20
4
6
5
4
6
3
3
2
3
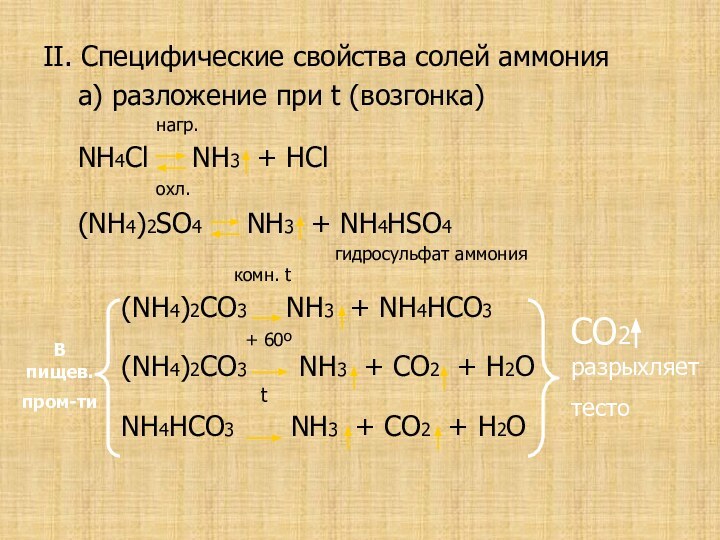
t
В пищев.
пром-ти
CO2 разрыхляет
тесто