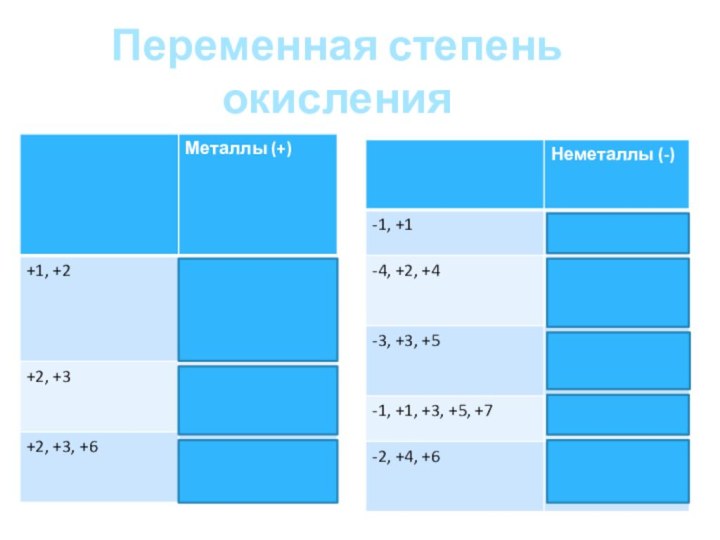
которых не равна номеру группы, в которой они находятся
периодической системе;Соединения водорода и кислорода, в которых эти элементы имеют не характерные для них степени окисления.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть









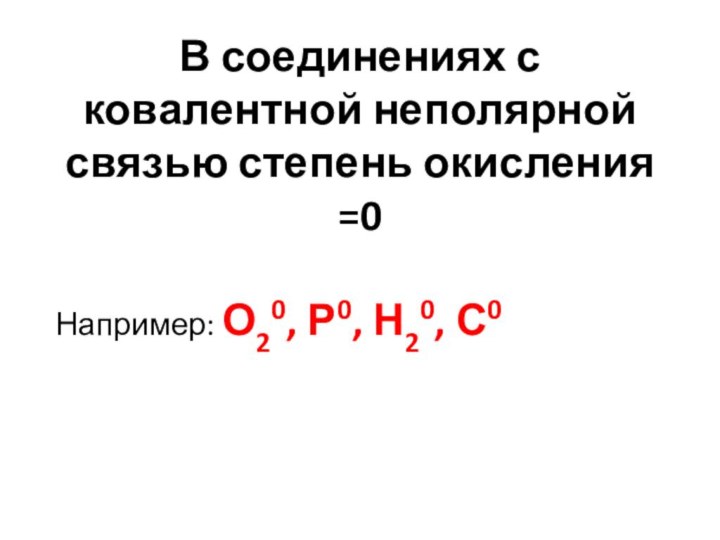








Запомни
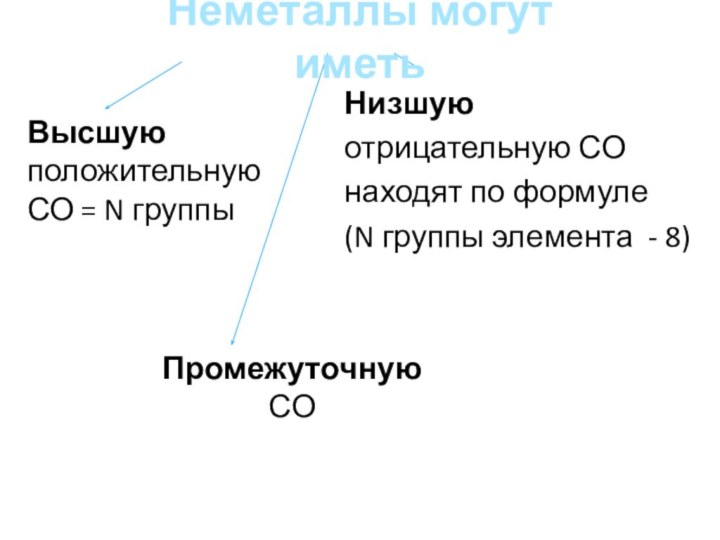
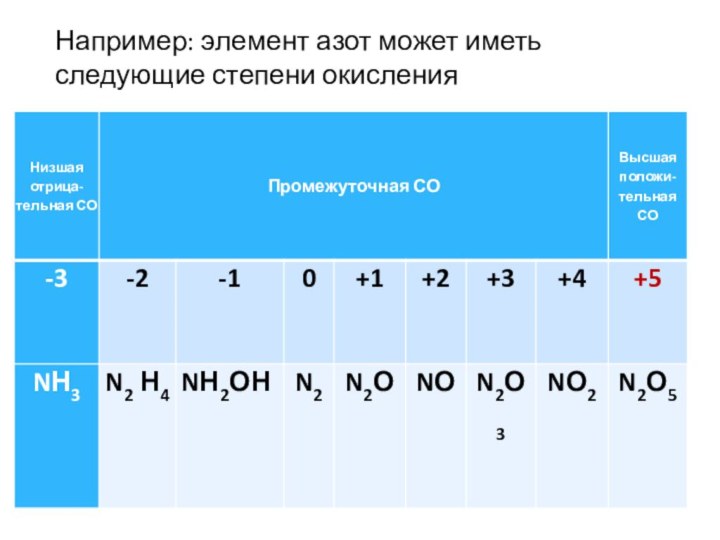
Промежуточную СО
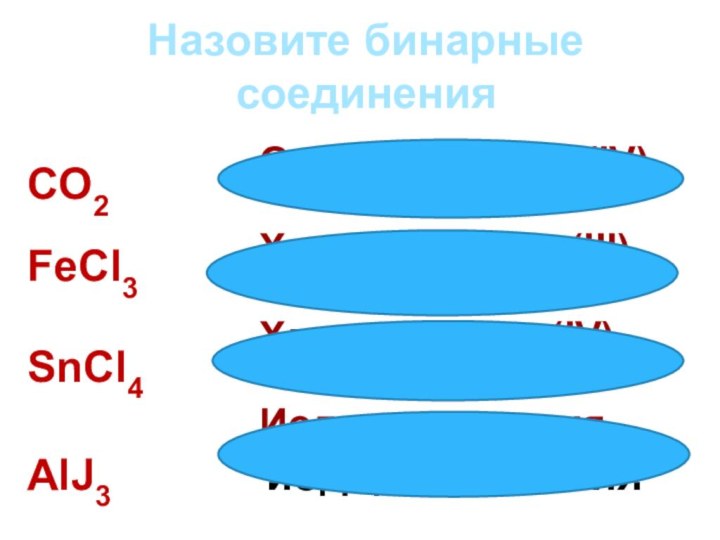
Оксид углерода (IV)
Хлорид железа (III)
Хлорид олова (IV)
Иодид алюминия
Проверка:
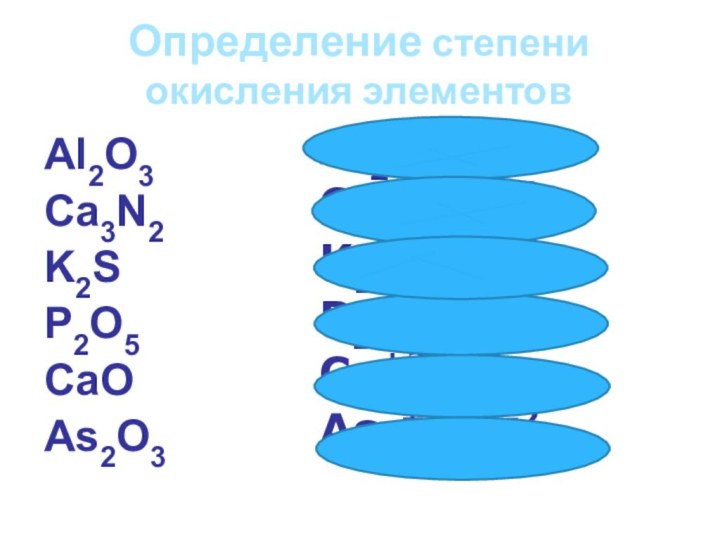
1. MnO, Mn2O3, MnO2, Mn2O7
2. Na3N, Ca3N2, AlN
3. BaH2, SbCl5, Al2S3, PCl3, PCl5