- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему к уроку по химии в 9 классе Щелочные металлы
Содержание
- 2. Цель:Дать общую характеристику щелочных металлов
- 3. Задачи:Рассмотреть положение щелочных металлов в ПСХЭ Д.МенделееваИзучить
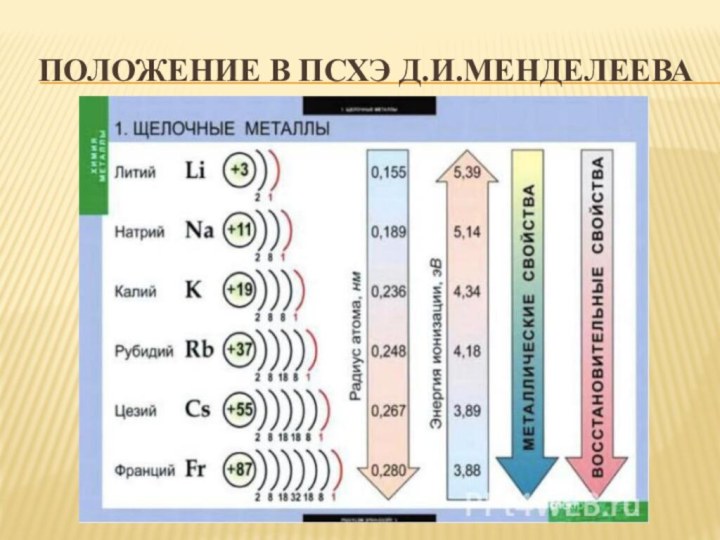
- 4. Положение в ПСХЭ Д.И.Менделеева
- 5. Физические свойства Серебристо – белыеМягкие (режутся ножом)ЛегкиеЛегкоплавкиеХранят под слоем керосина или вазелина
- 6. Химические свойства 1) Взаимодействие с кислородом2Li +O2
- 7. 2) Взаимодействие с неметаллами2Na+H2= 2NaH (гидрид натрия)2Li
- 9. ГидроксидыNaOHЕдкий натрKOHЕдкий калий
- 10. Важнейшие соединения Шелочных металловNaCl – каменная сольNa2SO4
- 11. NaCl (каменная соль)
- 12. Na2SO4 · 10H2O (глауберова соль)
- 13. NaNO3 (селитра)
- 14. NaCl · KCl (сильвинит)
- 15. K2CO3 (поташ)
- 16. ТЕСТ1.К щелочным металлам не относится: а) рубидий;
- 17. 6. К физическим свойствам щелочных металлов не
- 18. Скачать презентацию
- 19. Похожие презентации
Цель:Дать общую характеристику щелочных металлов
















Слайд 3
Задачи:
Рассмотреть положение щелочных металлов в ПСХЭ Д.Менделеева
Изучить физические
и химические свойства щелочных металлов
металлов и их применениями
Слайд 5
Физические свойства
Серебристо – белые
Мягкие (режутся ножом)
Легкие
Легкоплавкие
Хранят под
слоем керосина или вазелина
Слайд 6
Химические свойства
1) Взаимодействие с кислородом
2Li +O2
= Li2O (оксид лития)
2Na + O2 = Na2O2 (пероксид
натрия)Пероксиды – это оксиды, в которых связь
осуществляется между двумя атомам кислорода
2Na + Na2O2 = 2Na2O (оксид натрия)
Слайд 7
2) Взаимодействие с неметаллами
2Na+H2= 2NaH (гидрид натрия)
2Li +Cl2
= 2LiCl (хлорид лития)
2K + S = K2S (сульфид
калия)3) Взаимодействие с водой
а) 2М + 2H2O = 2MOH + H2
б) М2О + H2O = 2MOH
Слайд 10
Важнейшие соединения Шелочных металлов
NaCl – каменная соль
Na2SO4 ·
10H2O – глауберова соль
NaNO3 - селитра
NaCl · KCl
- сильвинит K2CO3 - поташ
Слайд 16
ТЕСТ
1.К щелочным металлам не относится:
а) рубидий;
б)
цезий;
в) калий;
г) медь.
2.Положение электронов в
атоме 2е 8е 8е 1е соответствует элементу: а) литию;
б) калию;
в) натрию;
г) меди.
3.Радиус атома у элементов I группы главной подгруппы с увеличением заряда ядра:
а) изменяется периодически;
в) не изменяется;
б) увеличивается;
г) уменьшается.
4.Щелочные металлы проявляют очень сильные:
а) окислительные свойства;
б) амфотерные свойства;
в) восстановительные свойства;
г) нейтральные свойства.
5.Во всех своих соединениях щелочные металлы проявляют степень окисления
а) +1;
б) +3;
в) +2;
г) +4.
Слайд 17 6. К физическим свойствам щелочных металлов не относится:
а) серебристо-белые ;
б) мягкие и легкие;
в)
хорошие электропроводники;г) тугоплавкие.
7. При взаимодействии элементов I группы главной подгруппы с водой образуется:
а) кислота;
б) щелочь и выделяется водород;
в) оксид и выделяется водород;
г) соль.
8. При взаимодействии кислорода со щелочными металлами оксид образуется только с:
а) литием;
б) натрием;
в) калием;
г) рубидием.
9. Щелочные металлы не взаимодействуют с:
а) неметаллами;
в) водой;
б) растворами кислот;
г) концентрированными кислотами.
10. Натрий и калий хранят в керосине или в минеральном масле, потому что они:
а) имеют резкий запах;
б) очень легкие;
в) легко окисляются на воздухе;
г) сильные окислители.





























