Слайд 2
Анализ катионов IV аналитической группы
Содержание
Действие раствора гидроксида натрия
Изучение
свойств растворов
Реакция восстановления Реакция восстановления Fe(III) Реакция восстановления
Fe(III) до Реакция восстановления Fe(III) до Fe(II)
Реакция окисления Реакция окисления CrРеакция окисления Cr пероксидом водорода
Реакция образования надхромовой кислоты
Образование окрашенных перлов буры
Действие Действие K4[Fe(CN)6]
ДействиеДействие дитизона
Действие р-ра натрия ацетата
Действие кобальта нитрата
Систематический ход анализа катионов Систематический ход анализа катионов IVСистематический ход анализа катионов IV аналитической группы
Слайд 3
Опыт 1. Действие раствора гидроксида натрия
К 3-4 каплям
отдельно взятых растворов солей алюминия, цинка, олова(II), олова(IV), хрома
приливали по 4 капли раствора натрия гидроксида. Поместили в две пробирки небольшое количество каждого из осадков и прилили в одну из пробирок избыток натрия гидроксида, в другую - раствор минеральной кислоты.
Слайд 4
Опыт 1. Действие раствора гидроксида натрия
При добавлении
гидроксида натрия:
2NaOH + ZnCl2 → 2NaCl + Zn(OH)2↓(белый студенистый)
AlCl3 + 3NaOH(разб.) → Al(OH)3↓ (белый
студ.)+ 3NaCl
2NaOH + SnCl2 → 2NaCl + Sn(OH)2↓(бел. осадок)
6NaOH + Cr2(SO4)3 → 3Na2SO4 + 2Cr(OH)3↓(аморфн. осадок зел. цвета)
При добавлении к осадкам изб. щелочи(наблюдали растворение осадков):
Al(OH)3 + OH- → [Al(OH)4]-
Cr(OH)3 + 3OH- → [Cr(OH)6]3-
Zn(OH)2 + 2OH- → [Zn(OH)4]-
Sn(OH)2 + 4OH- → [Sn (OH)6]4-
Слайд 5
Опыт 1. Действие раствора гидроксида натрия
При добавлении к
осадком р-ра минеральной кислоты:
Zn(OH)2+2HCl=ZnCl2(бел.осадок)+2H2O
Al(OH)3+3HCl=AlCl3(бел. осадок)+3H2O
Cr(OH)3+3HCl=CrCl3(зел. цвет)+3H2O
Sn(OH)2+2HCl=SnCl2(прозрачный)+2H2O
Sn(OH)4+4HCl=SnCl4+4H2O
Слайд 6
Опыт 1. Действие раствора гидроксида натрия
Слайд 7
Опыт 2. Изучение свойств растворов
К 5-6 каплям
солей Al, Zn, Cr, Sn(II), Sn(IV) прибавляли избыток натрия
гидроксида до растворения осадков гидроксидов, которые получали в начале прибавления. Полученные растворы делили на три части: одну – нагревали, к другой добавляли немного твердого аммония хлорида, к третьей – прибавляли по капле хлороводородную кислоту.
Слайд 8
Опыт 2. Изучение свойств растворов
ZnCl2 +2 Избыток
NaOH = Na2[Zn(OH)2] +HCL
AlCl3 +2 Избыток NaOH = Na3[Al(OH)6]
+HCL
2CrCl3 +6 Избыток NaOH =2 Na3[Cr(OH)6] + HCL
SnCl2 + Избыток NaOH = Na2[Sn(OH)4] + 2НCl
SnCl4+ Избыток NaOH = Na2[Sn(OH)6] +HCL
При добавлении гидроксида натрия избытка образовывались гидроксокомплесы.
При нагревании:
Na3[Cr(OH)6] + 3СО2 = Cr(OH)3 + 3NaHCO3
2 Na3Al(OH)6+ 3 CO2 = 3 Na2CO3 + 2 Al(OH)3 + 3 H2O
Так же и при нагревании образуются исходные гидроксиды (Na3[Cr(OH)6],Na2[Sn(OH)4] ,Na2[Sn(OH)6] ).
Слайд 9
Опыт 3. Реакция восстановления Fe(III) до Fe(II)
К 2-3
каплям соли железа(III) прибавляли по 2 капли 2М растворов
соляной кислоты и гексацианоферрат(III) калия. К полученной соли прибавляли каплю раствора соли олова(II).
Наблюдали переход окраски с бурого цвета железа(III) до зеленого цвета соединения с железом со степенью окисления(II).
Слайд 10
Опыт 3. Реакция востановления Fe(III) до Fe(II)
Слайд 11
Опыт 4. Реакция окисления Cr пероксидом водорода
К 2-3
каплям раствора соли хрома(3) прибавляют 5-6 капель 2М раствора
натрия гидроксида , 2-3 капли 3% раствора пероксида водорода и нагревали пробирку на водяной бане в течении нескольких минут. Наблюдаем переход зеленой окраски раствора в желтую.
Слайд 12
Опыт 4. Реакция окисления Cr пероксидом водорода
Слайд 13
Опыт 5. Реакция образования надхромовой кислоты
1-2 капли раствора
калия хромата, разбавленного 5 каплями дистиллированной воды, подкисляли 2
каплями минеральной кислоты, прибавляли 4-5 капель амилового спирта и каплю раствора пероксида водорода.
Наблюдали образование надхромовой кислоты синего цвета.
Слайд 14
Опыт 5. Реакция образования надхромовой кислоты
Слайд 15
Опыт 6. Образование окрашенных перлов буры
Прокаливали ушко платиновой
проволоки до красного цвета, дотрагивались им до твердого натрия
тетрабората и прокаливали в пламени газовой горелки, пока масса не пересталп пениться. Охладили полученную стекловидную массу и,взяв немного осадка гидроксида хрома(III), снова прокалоли. После охлаждения отметили цвет перла в проходящем свете.
3Na2B4O7 + 2Cr(NO3)3 = 6NaBO2 + 2Cr(BO2)3 + 3N2O5
Слайд 16
К 2-3 каплям соли цинка прибавляли 2 капли
раствора гексацианоферрата(II) калия. Испытывали отношение полученного осадка к соляной
кислоте.
При добавлении гексацианоферрата (2) калия получался осадок белого цвета.
Опыт 7. Действие K4[Fe(CN)6]
Слайд 17
К 8 каплям раствора соли цинка прибавляли 5
капель аммиачного буферного раствора и 5 капель раствора дитизона.
Наблюдали оранжевое окрашивание.
Опыт 8. Действие дитизона
Слайд 18
К 2-3 каплям раствора соли алюминия прибавляли 10
капель раствора аммиака и 2 капли раствора ализарина. При
появлении фиолетовой окраски прибавляли по каплям уксусную кислоту до перехода фиолетовой окраски в красную.
AlCl3+3NH4OH+C14H6O2(OH)2=Al(OH)2C14H6O2(OH)↓+3NH4Cl+H2O.
Наблюдали образование ализаринового лака.
Опыт 9. Действие ализарина
Слайд 19
К 2-3 каплям раствора соли алюминия прибавляли 2
капли раствора натрия ацетата и нагревают на водяной бане.
Наблюдаем
образование хлопьевидного осадка
AlCl3 + CH3COONa + H2O = Al(OH)(CH3COO)2 + CH3COOH + NaCl
Опыт 10. Действие р-ра натрия ацетата
Слайд 20
К 2-3 каплям раствора соли алюминия прибавляли 2
капли раствора аммиака, выпавший осадок гидроксида алюминия отфильтровывали, фильтр
осторожно высушивали, смачивали разбавленным раствором нитрата кобальта, подсушивали и прокаливали в пламени горелки.
Опыт 11. Действие кобальта нитрата
Слайд 21
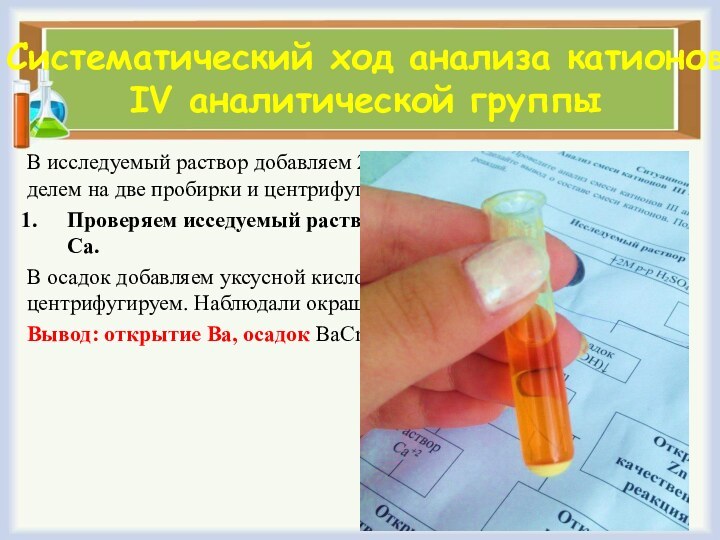
Систематический ход анализа катионов IV аналитической группы
В исследуемый
раствор добавляем 2М р-р H2SO4 и 50% C2H5OH, делем
на две пробирки и центрифугируем.
Проверяем исседуемый раствор на наличие катиона Ва или Са.
В осадок добавляем уксусной кислоты, а затем K2CrO4 и центрифугируем. Наблюдали окрашивание осадка в оранжевый цвет.
Вывод: открытие Ва, осадок ВаCrO4.
Слайд 22
Систематический ход анализа катионов IV аналитической группы
2. Проверяем
исследуемый раствор на наличие катиона Al или Zn.
В исследуемый
раствор добавляем NH4OH изб. и центрифугируем. Фильтрат капаем на фильтровальную бумагу и добавляем Co(NO3)2. Бумагу помещаем в тигель и поджигаем над пламенем спиртовки. Наблюдали золу окрашенный в зелёный цвет (зелень Ринмана).
Вывод: открытие Zn.







![Анализ катионов IV аналитической группы Опыт 2. Изучение свойств растворов ZnCl2 +2 Избыток NaOH = Na2[Zn(OH)2] +HCLAlCl3](/img/tmb/12/1151345/36cf9049ab7578d9671e33ce86462d68-720x.jpg)