- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Азотная кислота и ее соли
Содержание
- 2. План изучения азотной кислоты. 1.Состав .2.Строение.3.Физические свойства.4.Химические свойства.5.Получение и применение.
- 3. Состав и строение азотной кислоты. -Запишите
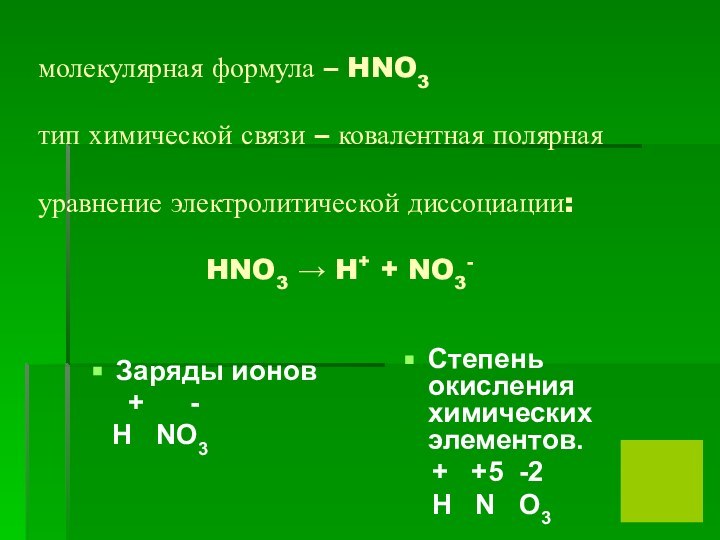
- 4. молекулярная формула – HNO3 тип химической
- 5. Перечислите физические свойства азотной кислоты? Что надо
- 6. Физические свойства. Азотная кислота – это бесцветная
- 7. HNO3 является сильным окислителем.Азотная кислота проявляет все
- 8. HNO3→H+ + NO3- 2HNO3+CuO→Cu(NO3)2+H2O HNO3+NaOH→NaNO3+H2O 2HNO3+Cu(OH)2→Cu(NO3)2+2H2O 2HNO3+Na2CO3→2NaNO3+CO2+H2O
- 9. Ни один из металлов не вытесняет из
- 10. Получение азотной кислоты.Предложите две цепочки превращений, приводящих к получению азотной кислоты, исходя из азота и аммиака.
- 11. §24,с.143,145; §25,с.150; §27,с.156,статья «Оксиды».
- 12. Применение азотной кислоты.§27, с.157 4 абзац.Где находит применение азотная кислота?
- 13. Скачать презентацию
- 14. Похожие презентации
План изучения азотной кислоты. 1.Состав .2.Строение.3.Физические свойства.4.Химические свойства.5.Получение и применение.












Слайд 2
План изучения азотной кислоты.
1.Состав .
2.Строение.
3.Физические свойства.
4.Химические свойства.
5.Получение
и применение.
Слайд 3 Состав и строение азотной кислоты. -Запишите молекулярную, электронную, структурную
формулы азотной кислоты. - Укажите тип химической связи в молекуле
азотной кислоты. -Расставьте заряды ионов и степени окисления химических элементов. -Составьте уравнение электролитической диссоциации .Слайд 4 молекулярная формула – HNO3 тип химической связи – ковалентная
полярная уравнение электролитической диссоциации:
HNO3 → H+ + NO3-Заряды ионов
+ -
H NO3
Степень окисления химических элементов.
+ +5 -2
H N O3
Слайд 5 Перечислите физические свойства азотной кислоты? Что надо сделать при
попадании на кожу азотной кислоты? Как правильно хранить азотную кислоту? На
каком свойстве азотной кислоты это основано?Слайд 6 Физические свойства. Азотная кислота – это бесцветная жидкость, имеет
резкий запах, легко испаряется, кипит при t 830. При попадании
на кожу может вызывать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой NaHCO3).С водой смешивается в любых соотношениях. Обычно применяемая в лаборатории азотная кислота содержит 63% HNO3 и имеет плотность 1,4 г/см3 . При хранении довольно легко, особенно на свету, разлагается по уравнению: 4HNO3→2H2O+ 4NO2↑ + O2↑ Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Слайд 7
HNO3 является сильным окислителем.
Азотная кислота проявляет все типичные
свойства сильных кислот: взаимодействует с оксидами и гидроксидами металлов,
с солями (составьте соответствующие уравнения реакций).С металлами она ведет себя по –особому – ни один из металлов не вытесняет из азотной кислоты водород, независимо от ее концентрации.
Почему азотная кислота является сильным окислителем?
Слайд 8
HNO3→H+ + NO3-
2HNO3+CuO→Cu(NO3)2+H2O
HNO3+NaOH→NaNO3+H2O
2HNO3+Cu(OH)2→Cu(NO3)2+2H2O
2HNO3+Na2CO3→2NaNO3+CO2+H2O
Слайд 9 Ни один из металлов не вытесняет из азотной
кислоты водород.
Продукт восстановления зависит от положения металлов в ряду
напряжений, от концентрации кислоты и условий проведения реакции.Например, при взаимодействии с медью концентрированная кислота восстанавливается до оксида азота(IV):
Cu+HNO3→Cu(NO3)2+NO2+H2O?
разбавленная – до оксида азота(ΙΙ):
Cu+HNO3→Cu(NO3)2+NO+H2O (расставьте коэффициенты методом электронного баланса).
Железо и алюминий при действии концентрированной HNO3 покрываются прочной оксидной пленкой, предохраняющей металл от дальнейшего окисления, т.е. кислота пассивирует их.
В чем особенность реакций между металлами и азотной кислотой? Почему азотную кислоту, можно перевозить в стальных и алюминиевых баллонах?