- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему ПО ХИМИИ НА ТЕМУ ЖЕСТКОСТЬ ВОДЫ
Содержание
- 3. Насколько «жестка» жесткая вода? Жёсткость
- 4. Жесткость воды
- 5. Влияние жесткости воды на здоровье человека
- 6. Химия жесткости воды Осадок и
- 7. Возникновение Жесткости Ионы кальция и
- 8. Умягчение водыУмягчение воды – процесс снижения жесткости
- 9. Методы умягчения воды: Реагентное умягчение воды, при
- 10. Устранение карбонатной жесткостиКипячение
- 11. Действие раствора соды Na2CO3: СaSO4 + Na2СО3
- 12. О содержании железа в питьевой воде
- 13. Скачать презентацию
- 14. Похожие презентации
Введение В пещерах спелеологи встречаются с красивейшими известковыми образованиями – свешивающимися со сводов сталактитами и растущими вверх сталагмитами. С точки зрения химии, возникновение этих удивительных творений природы











Слайд 2
Введение
образованиями – свешивающимися со сводов сталактитами и растущими вверх сталагмитами. С точки зрения химии, возникновение этих удивительных творений природы – это жесткость подземных вод.
Слайд 3
Насколько «жестка» жесткая вода?
Жёсткость воды –
это ее свойство, связанное с содержанием растворимых в ней
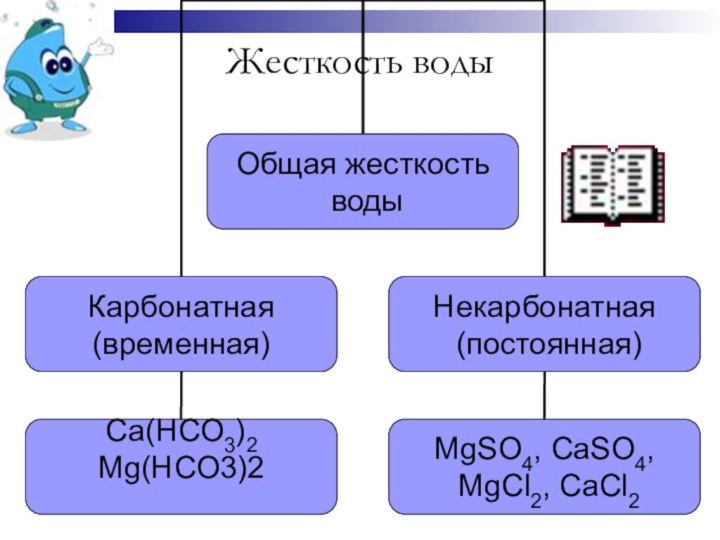
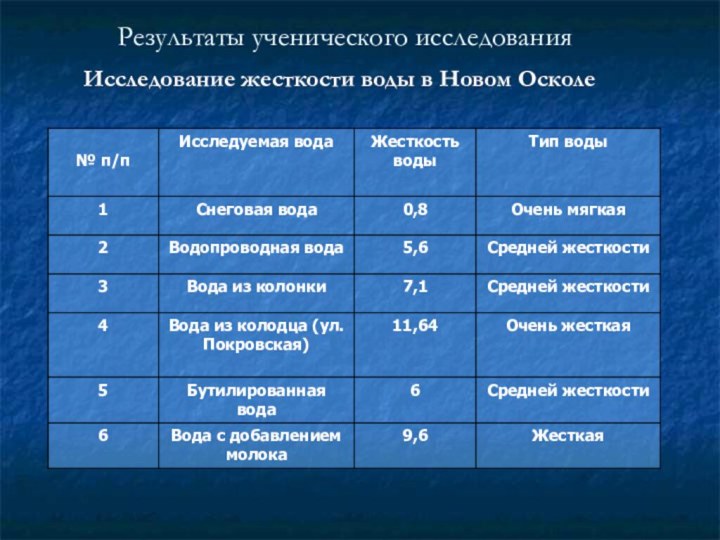
соединений кальция и магния, это параметр, показывающий содержание катионов кальция, магния в воде. Накипь на стенках нагревательных котлов, отложения солей на бытовой технике, и т.д. - все это показатели жесткой воды. Жесткая вода мало пригодна для стирки. Накипь на нагревателях стиральных машин выводит их из строя, катионы Ca2+ и Mg2+ реагируют с жирными кислотами мыла, образуя малорастворимые соли, которые создают пленки и осадки, в итоге снижая качество стирки. В настоящее время известна взаимосвязь жесткости воды и образования камней в почках. Жесткость питьевой воды по действующим стандартам должна быть не выше 7 мг-экв/л. Существует два типа жесткости: временная и постоянная. При большом содержании ионов магния, вода горьковата на вкус и оказывает послабляющее действие на кишечник. Различают карбонатную и некарбонатную жесткость. Карбонатная жесткость вызвана присутствием растворенных гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2. При кипячении гидрокарбонаты разрушаются с образованием осадков малорастворимых карбонатов CaCO3, жесткость уменьшается, поэтому карбонатную жесткость называют временной. При кипячении ионы Mg2+ и Ca2+ осаждаются в виде карбонатов. Жесткость, сохраняющаяся после кипячения воды, называется постоянной или некарбонатной. Она обусловлена растворенными в воде кальциевыми и магниевыми солями сильных кислот (сульфатами и хлоридами).
Слайд 5
Влияние жесткости воды на здоровье человека
Повышенная жесткость воды негативно сказывается на здоровье человека при
умывании. Соли жесткости взаимодействуют с моющими веществами и образуют нерастворимые шлаки. Эти шлаки высыхают и остаются в виде микроскопической корки на кожном и волосяном покрове человека. Разрушается естественная жировая пленка кожного и волосяного покрова человека, забиваются поры, появляется сухость, шелушение, перхоть. Признак повышенной жесткости воды – скрип чисто вымытой кожи и волос. Чувство повышенной мылкости, признак того, что защитная пленка на коже невредима, и жесткость воды небольшая. Поэтому косметологи советуют умываться дождевой или талой водой. С точки зрения применения воды для питьевых нужд, ее приемлемость по степени жесткости может существенно варьироваться в зависимости от местных условий. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая отрицательное действие на органы пищеварения. Кроме того, при взаимодействии солей жесткости с моющими веществами происходит образование "мыльных шлаков" в виде пены, она после высыхания остается в виде налета на сантехнике, белье, человеческой коже, на волосах.
Слайд 6
Химия жесткости воды
Осадок и накипь
(соли жесткости) образуются в результате взаимодействия катионов с анионами.
Ниже в таблице приведены основные анионы и катиониты металлов, с которыми они ассоциируются и вызывают жесткость. Железо, марганец и стронций оказывают на жесткость не большое влияние по сравнению с кальцием и магнием. Растворимость Алюминия и трехвалентного Железа маленькая при уровне pH природной воды, поэтому их влияние на жесткость воды также небольшое.
Слайд 7
Возникновение Жесткости
Ионы кальция и магния, а
также прочих щелочноземельных металлов, определяющих жесткость, присутствуют во всех
минерализованных водах. Их образуют месторождения известняков и гипса. Ионы кальция и магния попадают в воду при процессах растворения и химического выветривания горных пород. Ионы образуются при микробиологических процессах, протекающих в земле, где сбрасывается вода в донных отложениях. Как правило, в маломинерализованных водах преобладает жесткость, обусловленная ионами. При повышении минерализации воды содержание ионов кальция стремительно уменьшается. Количество же ионов магния в высокоминерализованных водах может доходить до нескольких граммов, а в соленых озерах - десятков граммов на один литр воды. Обычно жесткость подземных вод выше жесткости поверхностных вод. Жесткость поверхностных вод колеблется в зависимости от сезона, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья, когда обильно разбавляется мягкой дождевой и талой водой. Морская и океанская вода имеют очень высокую жесткость.
Слайд 8
Умягчение воды
Умягчение воды – процесс снижения жесткости воды,
т.е. уменьшение концентрации ионов кальция и магния. Жесткая вода
негативно сказывается на здоровье человека, на работе сантехнического и котельного оборудования. Поэтому, чтобы не испортить оборудование, требуется умягчение воды. При повышенной жесткости воды в котлах и бойлерах умягчение воды обязательно. Применяются несколько методов умягчения воды, которые выбираются, опираясь на факторы:Глубина умягчения воды
Качество исходной воды
Экономические соображения
Слайд 9
Методы умягчения воды:
Реагентное умягчение воды, при этом
способе очистки воды ионы Ca+2 и Mg+2 связываются различными
веществами в нерастворимые соединения.Электромагнитное воздействие на воду. Данный метод очистки воды не снижает ее жесткость, а предотвращает выпадение накипи, карбонатных отложений. Данный метод используется, где умягчение воды не является самоцелью.
Подробнее о химии жесткости воды.
Чтобы избавиться от временной жесткости необходимо просто вскипятить воду. При кипячении воды, гидрокарбонатные анионы вступают в реакцию с катионами и образуют с ними очень мало растворимые карбонатные соли, которые выпадают в осадок. Ca2 + 2HCO3- = CaCO3v + H2O + CO2^
С постоянной жесткостью бороться труднее. Один из вариантов: вымораживание льда. Необходимо просто постепенно замораживать воду. Когда останется примерно 10 % жидкости от первоначального количества, необходимо слить не замершую воду, а лед превратить обратно в воду. Все соли, которые образую жесткость, остаются в не замершей воде. Еде один способ – испарение воды с последующие ее конденсацией. Так как соли относятся к нелетучим соединениям, они остаются, а вода испаряется. Но такие методы, как замораживание и перегонка пригодны только для смягчения небольшого количества воды. С последствием жесткости воды - накипью, с точки зрения химии можно бороться очень просто. Нужно на соль слабой кислоты воздействовать кислотой более сильной.
Слайд 10
Устранение карбонатной жесткости
Кипячение
Са(НСО3)2 → СаСО3 ↓+ Н2О + СО2↑; Mg(НСО3)2 → MgСО3 ↓ + Н2О + СО2↑.
Действие известкового молока или соды:
Са(НСО3)2 + Са(ОН)2 → 2СаСО3 ↓ + 2Н2О ; Mg(НСО3)2 + Na2СО3 → MgСО3 ↓ + 2NaHCO3
Слайд 11
Действие раствора соды Na2CO3:
СaSO4 + Na2СО3 →
CaСО3 ↓ + Na2SO4;
MgCl2 + Na2СО3 → MgСО3
↓ + 2NaCl; Устранение некарбонатной (постоянной) жесткости
Слайд 12
О содержании железа в питьевой воде
Высокое содержание железа в воде вызывает отложение осадка в
трубах и их зарастание, а также ухудшает вкус питьевой воды (присутствует привкус ржавчины), а также после "железной" воды остаются желтые разводы на сантехнике и пятна на одежде. Железо практически всегда встречается в поверхностных и подземных скважинных водах. Также вследствие коррозии труб ржавчина попадает в питьевую воду.Соединения железа в воде присутствуют в растворенной и нерастворенной форме.
1. Для удаления ржавчины используют так называемые "механические" фильтры. Фильтрующие элементы представлены в виде промывающейся сетки из нержавеющей стали, также используются кварцевый песок, керамическая крошка. 2. Растворенное железо бывает в трехвалентной и в двухвалентной формах. Трехвалентная форма - это желтый раствор, двухвалентная - бесцветный раствор. В присутствии кислорода в воде двухвалентное железо очень быстро переходит в трехвалентную форму и образует малорастворимый гидроксид железа .
4Fe 2+ + O2 +2H2O = 4Fe(OH)3
При аэрировании происходит окисление двухвалентного железа в трехвалентную форму по следующей суммарной реакции:
4Fe2+ + O2 +10H2O = 4Fe (OH) 3 + 8H+
Также вместо кислорода воздуха для перевода Fe2+ в Fe3+ можно использовать и другие окислители, например, перманганат калия. Этими способами производят очистку воды от марганца (Mn2+), который часто сопутствует двухвалентному железу:
3Fe (HCO3)3 + KMnO3 + 2H2O = 3Fe (OH)3 + MnO2 + 5CO2 + KHCO3
В случае двухвалентного марганца происходит такая реакция окисления:
3Mn2+ + 2MnO4- + 2H2O = 5MnO2 + 4H+