- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии на тему Карбоновые кислоты (10 класс)
Содержание
- 2. ЦЕЛЬ УРОКА:1. Ознакомиться с основными представителями карбоновых
- 3. МНОГИЕ КИСЛОТЫ ИМЕЮТ ИСТОРИЧЕСКИ СЛОЖИВШИЕСЯ ИЛИ ТРИВИАЛЬНЫЕ
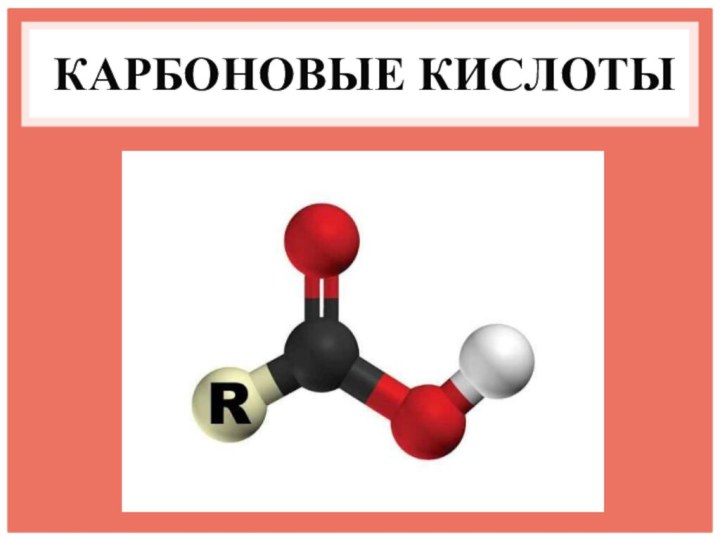
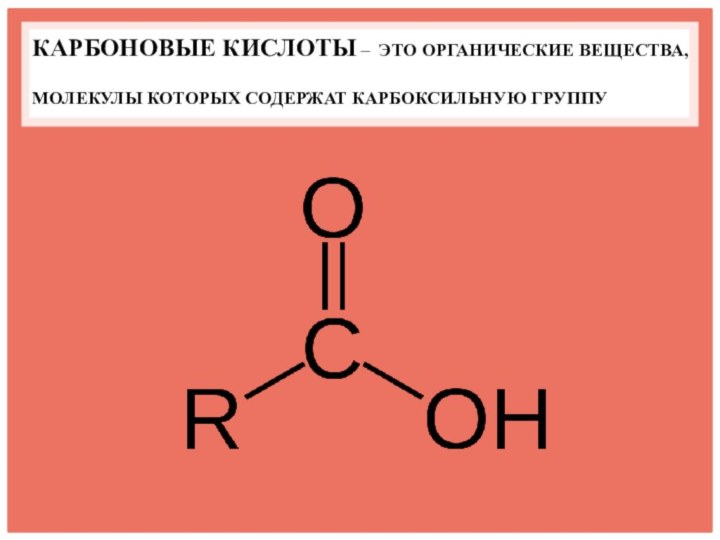
- 4. КАРБОНОВЫЕ КИСЛОТЫ – ЭТО ОРГАНИЧЕСКИЕ ВЕЩЕСТВА, МОЛЕКУЛЫ КОТОРЫХ СОДЕРЖАТ КАРБОКСИЛЬНУЮ ГРУППУ
- 5. Карбоновые кислоты – это кислородосодержащие органические вещества,
- 6. АЛГОРИТМ НАЗВАНИЯ КАРБОНОВЫХ КИСЛОТ:Находим главную цепь атомов
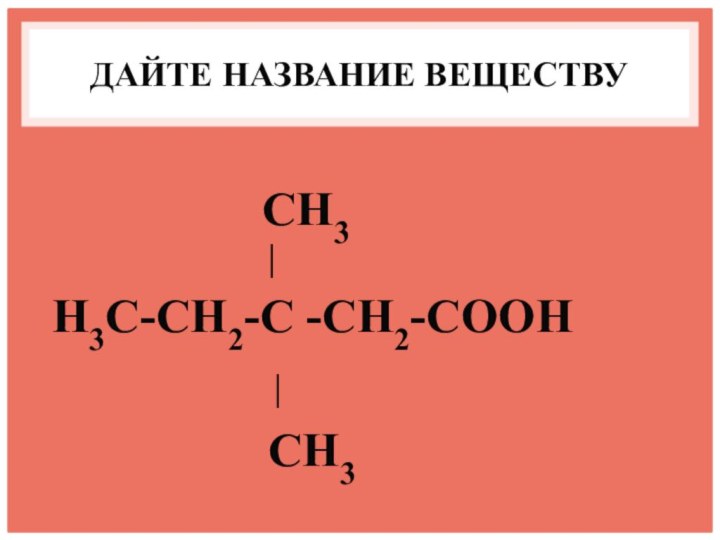
- 7. ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВУ
- 8. АЛГОРИТМ ЗАПИСИ ФОРМУЛ КАРБОНОВЫХ КИСЛОТ:Выделить корень слова
- 9. ФИЗИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
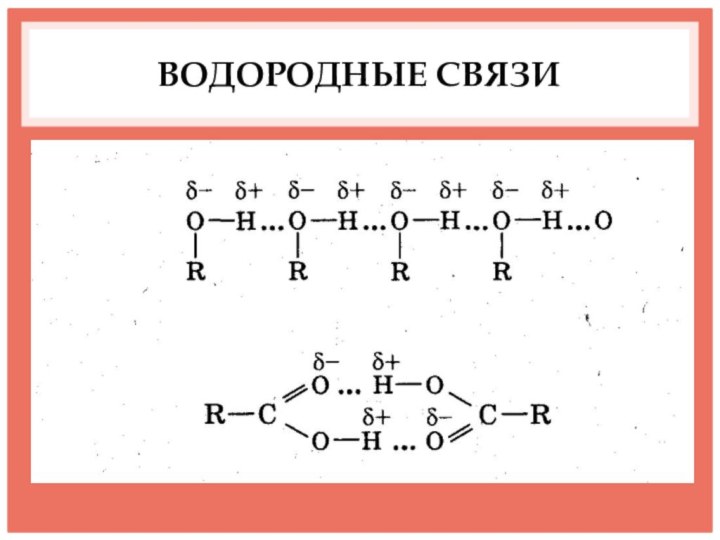
- 10. ВОДОРОДНЫЕ СВЯЗИ
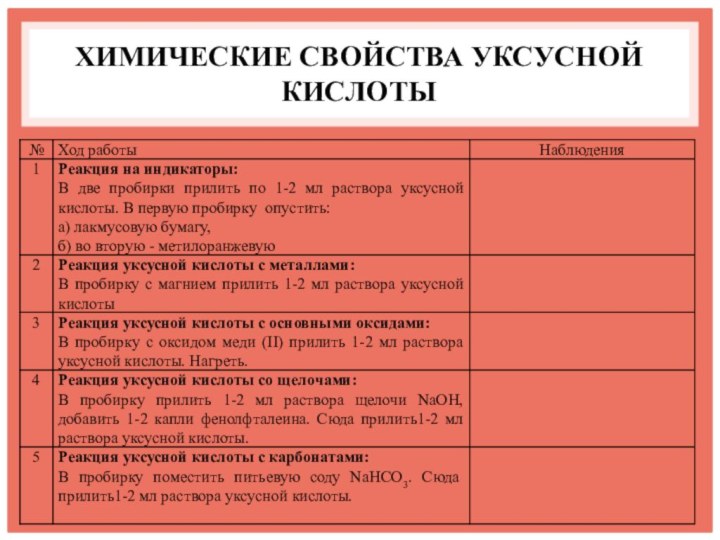
- 11. ХИМИЧЕСКИЕ СВОЙСТВА УКСУСНОЙ КИСЛОТЫ
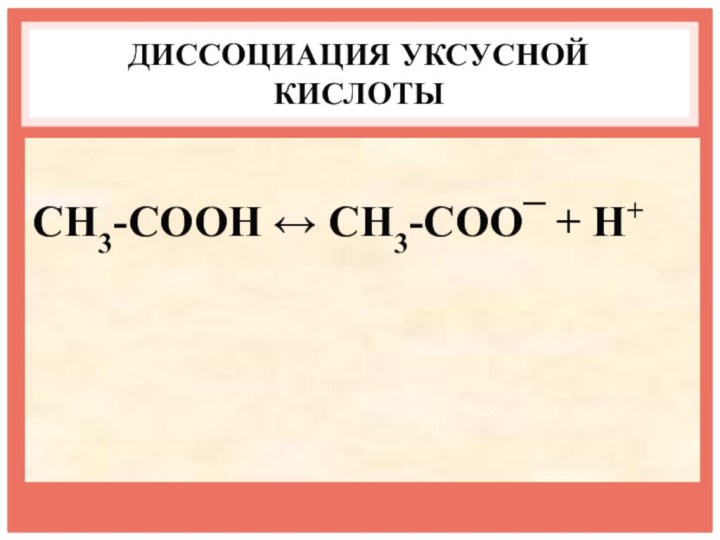
- 12. ДИССОЦИАЦИЯ УКСУСНОЙ КИСЛОТЫCH3-COOH ↔ CH3-COO¯ + H+
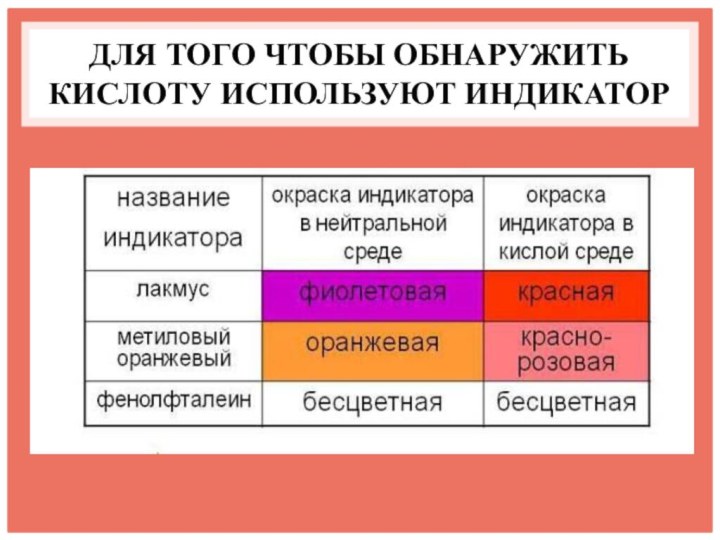
- 13. ДЛЯ ТОГО ЧТОБЫ ОБНАРУЖИТЬ КИСЛОТУ ИСПОЛЬЗУЮТ ИНДИКАТОР
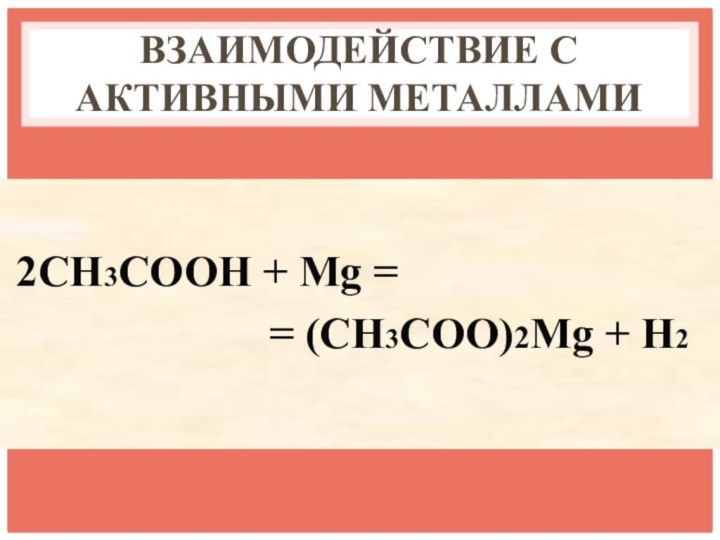
- 14. ВЗАИМОДЕЙСТВИЕ С АКТИВНЫМИ МЕТАЛЛАМИ2CH3COOH + Mg =
- 15. ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ2CH3COOH + CuO
- 16. ВЗАИМОДЕЙСТВИЕ СО ЩЕЛОЧАМИCH3COOH + NaOH = CH3COONa + H2O
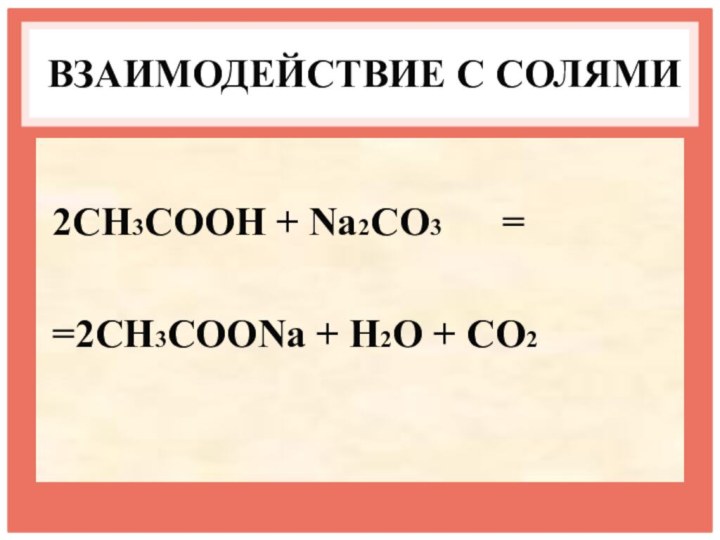
- 17. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ2CH3COOH + Na2CO3 = =2CH3COONa + H2O + CO2
- 18. ВЗАИМОДЕЙСТВУЯ СО СПИРТАМИ, КИСЛОТЫ ОБРАЗУЮТ ЭФИРЫCH3COOH +
- 19. ТЕСТИРОВАНИЕ:1. Какие из названных кислот являются органическими?
- 20. Скачать презентацию
- 21. Похожие презентации
ЦЕЛЬ УРОКА:1. Ознакомиться с основными представителями карбоновых кислот2. Изучить их строение, свойства, нахождение в природе и области применения











Слайд 3 МНОГИЕ КИСЛОТЫ ИМЕЮТ ИСТОРИЧЕСКИ СЛОЖИВШИЕСЯ ИЛИ ТРИВИАЛЬНЫЕ НАЗВАНИЯ,
СВЯЗАННЫЕ ГЛАВНЫМ ОБРАЗОМ С ИСТОЧНИКОМ ИХ ПОЛУЧЕНИЯ
Щавелевая кислота
Валериановая кислота
Яблочная
кислотаЛимонная кислота
Молочная кислота
Янтарная кислота
Масляная кислота
Слайд 4 КАРБОНОВЫЕ КИСЛОТЫ – ЭТО ОРГАНИЧЕСКИЕ ВЕЩЕСТВА, МОЛЕКУЛЫ КОТОРЫХ
СОДЕРЖАТ КАРБОКСИЛЬНУЮ ГРУППУ
Слайд 5 Карбоновые кислоты – это кислородосодержащие органические вещества, молекулы
которых содержат одну, две или более карбоксильных функциональных групп
-СООН, соединенных с углеводородным радикалом.
Слайд 6
АЛГОРИТМ НАЗВАНИЯ КАРБОНОВЫХ КИСЛОТ:
Находим главную цепь атомов углерода
и нумеруем её, начиная с карбоксильной группы.
Указываем положение заместителей
и их название (названия).После корня, указывающего число атомов углерода в цепи, идет суффикс «-овая» кислота.
Если карбоксильных групп несколько, то перед «- овая» ставится числительное ( -ди, - три…)
Пример:
3- метилбутан + -овая = 3-метилбутановая кислота
Слайд 8
АЛГОРИТМ ЗАПИСИ ФОРМУЛ КАРБОНОВЫХ КИСЛОТ:
Выделить корень слова на
основании, которого записать углеродный скелет в состав, которого входит
карбоксильная группа.Нумеруем атомы углерода, начиная с карбоксильной группы.
Указываем заместители согласно нумерации.
Необходимо дописать недостающие атомы водорода (углерод четырёхвалентен).
Проверить правильность записи формулы.
Пример: 2-метилбутановая кислота.
Слайд 18
ВЗАИМОДЕЙСТВУЯ СО СПИРТАМИ, КИСЛОТЫ ОБРАЗУЮТ ЭФИРЫ
CH3COOH + HOC2H5
= CH3-CO-O-C2H5 + H2O
уксусноэтиловыйэфир
В природе эфиры содержатся в цветах, плодах, ягодах. Их используют в производстве фруктовых вод и духов.
Слайд 19
ТЕСТИРОВАНИЕ:
1. Какие из названных кислот являются органическими?
а) муравьиная;
б) азотная;в) серная; г) лимонная.
2. Почему болезненны укусы муравьев?
а) обжигают муравьиной кислотой; б) выделяют яд;
в) разъедают муравьиной щелочью; г) вонзают острые зубчики.
3. Как называют соли уксусной кислот?
а) ацетаты; б) бустилаты;
в) пропилаты; г) постулаты.
4. Какого названия кислоты не существует?
а) лимонная; б) щавелевая;
в) винная; г) виноградная.
5. Какие кислоты являются витаминами?
а) никотиновая; б) аскорбиновая;
в) ацетилсалициловая; г) янтарная.





























