- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему АЗОТСОДЕРЖАЩИЕ-ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Содержание
- 2. АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ К
- 3. Студент должен: знать стоение, номенклатуру, свойства,
- 4. В настоящем лабораторном
- 5. Амины алифатического ряда Амины
- 6. Так как в
- 7. Амины могут содержать
- 8. С аминами тесно
- 11. Номенклатура аминов По правилам
- 12. Для наименования первичных
- 13. Названия аминов могут
- 16. Химические свойства
- 18. Под влиянием
- 19. Увеличение основных свойств
- 20. Алкилы увеличивают
- 21. CH3 NH2 + HCl
- 23. Реакции аминов с азотистой кислотой
- 24. Вторичные амины при
- 25. Например:
- 26. Аминокислоты Аминокислотами называют
- 27. Строение, изомерия и номенкулатура Изомерия
- 28. Простейшей
- 29. Химические свойства
- 30. Амфотерность аминокислот Аминокислоты –
- 31. NH2 CH2 COOH +
- 32. Кислотная и основная
- 33. CH2
- 34. Реакции аминогрупп в аминокислотах
- 35. Функциональные производные аминокислот
- 36. Отличительные свойства α, β, γ и δ-аминокислот
- 37. H2N CH C
- 38. Таким же путем
- 39. Белковые вещества.
- 40. В природе
- 41. При нагревании с
- 42. Каждый организм из
- 43. Строение белков. Различные
- 45. Таким образом, белки,
- 46. Природа белка определяется
- 47. Большое значение имеет
- 48. Характерная особенность полипептидных
- 49. Спирали
- 50. Свойства белков.
- 51. Все
- 53. Осаждение белков из растворов.
- 55. Цветные реакции белков. Биуретовая реакция.
- 56. Таким образом, биуретовая
- 57. Ксантопротеиновая реакция.
- 58. Например,
- 60. Классификация белков.
- 61. Среди протеинов
- 62. Белковые
- 63. Ароматические амины
- 64. Номенклатура и изомерия
- 65. Простейшими
- 66. Толуидины по
- 67. а) жирно-ароматические
- 68. б) чисто ароматические
- 69. Химические свойства Реакции за счет аминогруппы
- 70. Основные
- 71. Реакции с азотистой кислотой
- 72. Третичные
- 73. Реакции за счет ароматического ядра
- 74. Действие окислителей.
- 75. Способы получения ароматических аминов
- 76. Ароматические диазосоединения и азосоединения (азокрасители)
- 77. В диазосоединениях
- 78. Диазосоединения существуют в
- 79. Под
- 80. Простейшее
- 82. Получение ароматических диазосоединений Диазосоединения
- 85. Химические свойства диазосоединений Соли
- 86. Реакции, протекающие с выделением азота.
- 87. Если соль
- 88. Реакции, протекающие без выделения азота.
- 89. Получение азосоединений
- 91. Полная схема
- 92. 2) азосочетание
- 93. Скачать презентацию
- 94. Похожие презентации
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ К азотсодержащим органическим соединениям относят многочисленные органические соединения, как природного происхождения, так и синтетические, в молекулах которых содержатся атомы азота. К ним относятся белковые вещества, многие важнейшие физиологически активные соединения,


























































































Слайд 3 Студент должен: знать стоение, номенклатуру, свойства, способы получения и применение
азотсодержащих производных углеводородов умень составлять названия и химические уравнения реакций азотсодержащих
производных углеводородовСлайд 4 В настоящем лабораторном практикуме
рассмотрены те азотсодержащие органические соединения, в молекулах которых атом
азота непосредственно связан с атомом углерода: амины, аминокислоты, белковые вещества, диазо- и азосоединения.
Слайд 5
Амины алифатического ряда
Амины -
органические соединения, которые можно рассматривать как производные углеводородов, образованные
в результате замещения атомов водорода в углеводородной молекуле остатками аммиака (аминогруппами). Амины рассматривают и как производные аммиака, в котором атомы водорода замещены углеводородными радикаламиR – H NH3 R – NH2
углеводород аммиак амин
Слайд 6 Так как в аммиаке
радикалами могут быть последовательно замещены все водородные атомы, существуют
три группы аминов. Амины, в которых азот соединен с однимрадикалом, называются первичными,
с двумя радикалами – вторичными
и с тремя радикалами – третичными
R R
| |
R – NH2 R – NH R – N – R
первичный вторичный третичный
амин амин амин
Слайд 7 Амины могут содержать одну,
две и более аминогрупп, соответственно различают моноамины, диамины и
т.д.Следует иметь в виду, что диамины с двумя аминогруппами при одном углеродном атоме не существуют. Поэтому простейшим диамином является этилендиамин, содержащий две аминогруппы при различных углеродных атомах:
NH2 – CH2 – CH2 – NH2
этилендиамин
(1,2 - этандиамин)
Слайд 8 С аминами тесно связаны
органические вещества, являющиеся производными аммониевых соединений.
Производные гидроксида аммония, содержащие в комплексном аммониевом катионе вместо атомов водорода радикалы, называют гидроксидами замещенного аммония; соединения, содержащие ион четырехзамещенного аммония, в котором с азотом вместо всех четырех атомов водорода связаны четыре радикала, называют четвертичными аммониевыми основаниями: Слайд 9
[NH4]+ OH-
гидроксид
аммония гидроксид четырехзамещенного
аммония
(четвертичное аммониевое
основание)
Слайд 10
При замещении радикалами атомов водорода в аммониевых
солях образуются соли замещенного аммония, например:[NH4] Cl
хлорид аммония хлорид четырехзамещенного
(соль аммония) аммония
(соль четвертичного
аммониевого основания)
Слайд 11
Номенклатура аминов
По правилам
Международной номенклатуры, если аминогруппа в соединении является главной, наличие
ее обозначают окончанием – амин; когда имеется несколько таких групп, используют окончание с греческими числительными –диамин, триамин и т.д.Слайд 12 Для наименования первичных аминов
или диаминов с первичными аминогруппами указанные окончания добавляются к
названиям соответствующих одновалентных или двухвалентных радикалов:CH3
|
CH3 – NH2 CH3 – CH – NH2
метиламин изопропиламин
CH2 – CH2 – CH2 – CH2
| |
NH2 NH2
тетраметилендиамин
Слайд 13 Названия аминов могут быть
произведены и от заместительных названий соответствующих углеводородов, тогда цифрами
указывают атомы углерода главной цепи, связанные с аминогруппой. НапримерCH3
5 4 3 2 1
CH3 CH CH2 CH CH3
NH2
4-метил-2-пентанамин
Слайд 14
Названия вторичных и третичных аминов с одинаковыми радикалами образуются
из названий этих радикалов и указывающих их число греческих числительных. Например:CH2 CH3
СH3 NH CH3 CH3 CH2 N CH2 CH3
диметиламин триэтиламин
Слайд 15 Название
соединений, содержащих ион
замещенного аммония составляют из наименований радикалов:
CH3 CH3
CH3 N+ CH3 OH- CH3 N+ CH3 Cl-
CH3 C2H5
гидроксид хлорид
тетраметиламмония диметилэтиламмония
Слайд 16
Химические свойства
Как
производные аммиака амины проявляют основные свойства и являются органическими
основаниями. Подобно аммиаку амины с водой образуют катионы замещенного аммония и гидроксильные анионы:+
CH3 NH2 + HOH CH3 NH3 + OH ¯
метиламин ион метиламина
Слайд 17
Водные растворы аминов можно представить как растворы гидроксидов замещенного
аммония; в случае метиламина – гидроксида метиламмонияCH3 NH3 OH .
Они имеют щелочную реакцию и окрашивают лакмус в синий цвет.
Слайд 18 Под влиянием простейших
алкильных радикалов основные свойства аминогруппы увеличиваются, поэтому амины жирного
ряда являются более сильными основаниями, чем аммиак. Особенно сильные основные свойства проявляют четвертичные аммониевые основания.Слайд 19 Увеличение основных свойств аминогруппы
в аминах сравнительно с аммиаком объясняется электронодонорными свойствами алкильных
радикалов, их способностью отталкивать электроны связей, соединяющих их с другими атомами или группами:●● ●●
CH3 N H CH3 N H
H CH3
метиламин диметиламин
Слайд 20 Алкилы увеличивают общую
электронную плотность атома азота, несущего неподеленную электронную пару, и,
следовательно, его способность присоединять протон.Как основание аммиак с кислотами дает соли аммония. Аналогично проявляются основные свойства аминов.
Например:
Слайд 21 CH3 NH2 + HCl
CH3 NH3 Cl
метиламин хлорид метиламмония
CH3 NH2 + H2SO4 CH3 NH3 SO4
2
сульфат метиламмония
Слайд 22
Едкие щелочи, как более сильные
основания, вытесняют амины из их солей.
CH3 NH3 Cl + NaOH CH3 NH2 + H2O + NaCl
метиламин
Реакция ускоряется при нагревании.
Слайд 23
Реакции аминов с азотистой кислотой
При действии азотистой кислоты (HNO2) на
первичные амины выделяются газообразный азот
и вода и образуется спирт:
R N H2 + O = N OH R OH + N2 + H2O
первичный азотистая спирт
амин кислота
Например:
CH3 N H2 + O = N OH CH3OH + N2 +H2O
метиламин метанол
Слайд 24 Вторичные амины при действии
на них азотистой кислоты образуют нитрозамины:
R
RN H + HO N = О N = N = О + H2O
R R
вторичный азотистая нитрозамин
амин кислота
Слайд 25
Например:
CH3
CH3
N H + HO N = О N N = О +H2O
CH3 CH3
диметиламин диметилнитрозамин
Третичные амины, в которых при азоте нет водорода, не реагируют с азотистой кислотой.
Слайд 26
Аминокислоты
Аминокислотами называют карбоновые
кислоты, в углеводородных радикалах которых один или несколько атомов
водорода замещены остатками аммиака - аминогруппами. Чаще всего атомы водорода замещаются на первичные аминогруппы. Тогда в общем виде строение аминокислот выражается формулойH2N R COOH.
Поскольку в аминокислотах находятся различные функциональные группы, они являются соединениями со смешанными функциями.
Слайд 27
Строение, изомерия и номенкулатура
Изомерия аминокислот
определяется положением аминогрупп по отношению к карбоксильным группам; строением
углеродного скелета и наличием асимметрических углеродных атомов.Названия аминокислот, поскольку в них главной функциональной группой является карбоксил, выводят из тривиальных или систематических названий соответствующих по углеродному скелету незамещенных кислот, добавляя к ним приставку амино-; положение аминогруппы по отношению к карбоксилу обозначают либо буквами греческого алфавита, либо цифрами. Для аминокислот общеприняты тривиальные названия.
Слайд 28 Простейшей является
аминоуксусная (аминоэтановая) кислота; иначе ее называют глицином или гликоколом:
CH3COOH H2N CH2 COOHуксусная аминоуксусная
кислота кислота
(глицин, гликокол)
Слайд 29
Химические свойства
Вследствие наличия в молекулах аминокислот одновременно карбоксильных и аминогрупп
они могут реагировать как кислоты и как амины. Некоторые же свойства аминокислот являются результатом взаимного влияния и взаимодействия карбоксильных групп и аминогрупп.
Слайд 30
Амфотерность аминокислот
Аминокислоты –
амфотерные соединения, образующие соли как с кислотами, так и
с основаниями. В первом случае в реакции участвует аминогруппа, во втором – карбоксильная группа.NH2 CH2 COOH + HCl N+ H3 CH2COOH
Cl ¯
глицин хлороводородная соль
глицина
Слайд 32 Кислотная и основная группы
внутри молекул аминокислот взаимодействуют друг с другом, благодаря этому
молекулы аминокислот представляют собой биполярные ионы. Поэтому, например, водные растворы одноосновных моноаминокислот нейтральны. Для глицина это можно представить следующей схемой:Слайд 33 CH2 COOH
CH2
COO ¯NH2 +NH3
глицин внутренняя соль глицина
Характерной особенностью аминокислот является способность к образованию внутрикомплексных солей с тяжелыми металлами.
Слайд 34
Реакции аминогрупп в аминокислотах
Аминокислоты с первичными аминогруппами реагируют с азотистой
кислотой подобно первичным аминам.СH3 CH COOH + HO N = O
NH2
α-аминопропионовая
кислота
CH3 CH COOH+ N2 + H2O
OH
α-гидроксипропионовая
кислота
Слайд 35
Функциональные производные аминокислот
Подобно незамещенным карбоновым кислотам, аминокислоты за счет карбоксильной группы
образуют различные производные: сложные эфиры, галогенангидриды, амиды и т.п. Например:O O O
C OH C OC2H5 C NH2
CH2 NH2 CH2 NH2 CH2 NH2
глицин сложный эфир амид
глицина глицина
Слайд 36
Отличительные свойства α, β, γ и δ-аминокислот
Различное взаимное расположение аминогрупп и
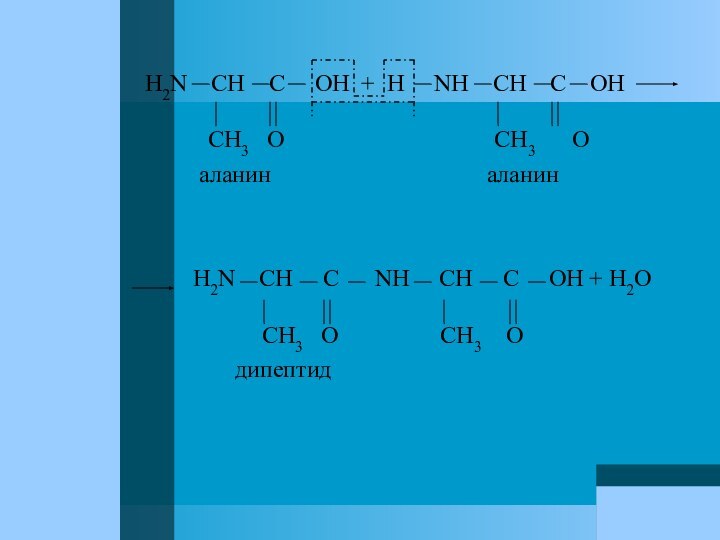
карбоксильных групп в молекулах аминокислот придает последним некоторые отличительные свойства. Например, молекулы α-аминокислоты в особых условиях могут реагировать друг с другом, образуя ациклические соединения типа амидов, называемые пептидами. Из двух молекул α-аминокислоты образуются дипептиды.Например:
Слайд 37
H2N CH C OH
+ H NH CH C
OHCH3 O CH3 O
аланин аланин
H2N CH C NH CH C OH + H2O
CH3 O CH3 O
дипептид
Слайд 38 Таким же путем из
многих аминокислотных молекул получают полипептиды. Образование полипептидов из α-аминокислот
лежит в основе синтеза белковых веществ в организмах.
Слайд 39
Белковые вещества.
Белковые вещества, или белки, представляют собой природные высокомолекулярные азотсодержащие
органические соединения, очень сложные молекулы которых построены из остатков α-аминокислот.Значение белков в природе исключительно велико, так как эти вещества играют первостепенную роль во всех явлениях жизни. Белки широко распространены в природе. Особенно много их содержат организмы животных и человека. Огромное значении белки имеют и для жизнедеятельности растительных организмов.
Слайд 40 В природе существует
огромное множество различных белков. Они различаются по молекулярной массе,
свойствам и той роли, которую играют в различных природных процессах. Очень часто белковые вещества представляют собой сложные смеси различных белков.Элементный состав белков непостоянен. Все они содержат углерод (50-55%), водород (6,5-7,3%), кислород (21,5-23,5) и азот (15-18%), в состав многих входит сера (0,3-2,5%), некоторые содержат фосфор, железо, йод, медь.
Слайд 41 При нагревании с кислотами
или со щелочами, а также при обычных температурах под
действием специальных ферментов белки расщепляются, подвергаясь гидролизу, т.е. разложению водой. Главными продуктами полного гидролиза белков являются смеси α-аминокислот. Из белковых гидролизатов выделено свыше 20 различных α-аминокислот. Именно α-аминокислоты, входящие в состав белков, определяют их пищевую ценность.Слайд 42 Каждый организм из аминокислот,
получаемых с белками пищи, синтезирует свои, необходимые ему белки.
При этом из 20 белков α-аминокислот наиболее важны восемь, которые называют незаменимыми аминокислотами; они поступают только с пищей и не могут образовываться в организме из остальных аминокислот или из других азотистых соединений. Остальные α-аминокислоты белков называются заменимыми – отсутствие или недостаток этих кислот в пище организм компенсирует, синтезируя их из других аминокислот или из иных азотистых соединений.
Слайд 43
Строение белков.
Различные α-аминокислоты,
образуя белки, соединяются за счет аминогрупп и карбоксильных групп
при помощи группировки CO NH , названной пептидной связью. В белковых молекулах имеются полипептидные цепи. Если строение α-аминокислот представить общей формулой (I), то образование полипептидной цепи (II) можно изобразить схемойСлайд 44
nH2N
CH C OHR O
α-аминокислоты
(I)
H2N CH C NH CH C NH CH C NH C OH
R O R O R O m O
полипептидная цепь белковой молекулы
(II)
Слайд 45 Таким образом, белки, являющиеся
природными высокомолекулярными соединениями, представляют собой продукты поликонденсации α-аминокислот. Полипептидные
цепи белков строятся из десятков и сотен молекул, причем не одной, а различных аминокислот. Образуя цепь, они могут соединяться друг с другом в различной последовательности, что приводит к огромному многообразию комбинаций аминокислотных остатков в полипептидных цепях.Слайд 46 Природа белка определяется не
только тем, какие аминокислоты входят в его состав, но
особенно и тем, в какой последовательности они соединяются друг с другом. Последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой белка. Она строго специфична для белков каждого индивидуального организма.Слайд 47 Большое значение имеет образование
между полипептидными цепями белков или между отдельными участками таких
цепей водородных и дисульфидных связей.Возникновение такого рода связей внутриполипептидных цепей также приводит к замыканию их в циклы различных размеров, к скручиванию, к образованию складок.
Слайд 48 Характерная особенность полипептидных цепей
многих белков – склонность закручиваться в спираль. Между отдельными
витками спирали образуются внутримолекулярные водородные связи, придающие ей устойчивость. В некоторых белках полипептидные цепи могут иметь так называемую β-форму, которая стабилизируется межмолекулярными водородными связями, соединяющими в своеобразные нити разные цепи. α-спиральная и нитевидная β-формы полипептидных цепей являются вторичной структурой белка.Слайд 49 Спирали и
нити вторичной структуры, а также неупорядоченные участки полипептидных цепей
могут различным способом сгибаться и складываться, образуя своеобразные «клубки»; таким образом создается третичная структура белка. Она стабилизируется внутримолекулярными взаимодействиями различного типа. Несколько «клубков» третичной структуры в некоторых белках ассоциируются, образуя еще более сложную четвертичную структуру белка.
Слайд 50
Свойства белков.
Белки – высокомолекулярные соединения. Некоторые из них обладают молекулярными
массами порядка десятков (13000-68000), другие сотен (225000-300000) тысяч. Молекулярная масса отдельных белков достигает нескольких миллионов.Белковые вещества разнообразны по своему агрегатному состоянию.
Слайд 51 Все белки
нерастворимы в безводном спирте и других органических растворителях. Многие
белки растворяются в воде и в разбавленных растворах солей, образуя коллоидные растворы. Имеются и белки, совершенно не растворяющиеся в воде.Белки, подобно аминокислотам, амфотерны и образуют соли как с кислотами, так и с основаниями. В их полипептидных цепях имеются свободные карбоксильные группы и аминогруппы.
Слайд 52
Наличие различных функциональных групп в боковых ответвлениях полипептидных цепей
придает белкам способность вступать во множество реакций; этим объясняется огромная роль белков в химических процессах, протекающих в организмах и осуществляющих явления жизни.Для всех белков характерны некоторые общие свойства: осаждение из растворов и цветные реакции.
Слайд 53
Осаждение белков из растворов.
При добавлении к водным растворам белков концентрированных
растворов минеральных солей (например, сульфата аммония) белки осаждаются (высаливаются). Осаждение их происходит и при добавлении органических растворителей (спирта, ацетона). Во всех этих случаях белки не изменяют своих свойств и при разбавлении водой вновь переходят в раствор.Слайд 54 Другие
реагенты – соли тяжелых металлов (сульфат меди, ацетат свинца),
а также кислоты (азотная, уксусная, пикриновая, трихлоруксусная) вызывают необратимое осаждение белков; под их воздействием происходит значительное изменение свойств (денатурация) белков, и они после осаждения теряют способность растворяться в воде и в разбавленных солевых растворах.При нагревании многие белки также денатурируются – свертываются (например, яичный белок) и осаждаются из растворов, теряя способность растворяться в воде.
Слайд 55
Цветные реакции белков. Биуретовая реакция.
При взаимодействии в щелочной среде с
солями меди (CuSO4) все белки дают фиолетовое (при сильном разбавлении сиреневое) окрашивание. Аналогичную реакцию дает уже упомянутый ранее биурет NH2 CO NH CO NH2, откуда происходит название этой реакции. В биурете имеются две пептидные группировки CO NH , которые и обуславливают появление окраски при взаимодействии с солями меди.Слайд 56 Таким образом, биуретовая реакция
белков подтверждает наличие в их молекулах пептидных связей. Эту
реакцию дают и полипептиды, образующиеся при гидролизе белков. При этом окраска, возникающая при взаимодействии с солями меди, для различных полипептидов не одинакова: дипептиды дают синюю окраску, трипептиды – фиолетовую, а более сложные полипептиды – красную.
Слайд 57
Ксантопротеиновая реакция.
Если
белки или их растворы нагревают с концентрированной азотной кислотой,
они окрашиваются в желтый цвет. Реакция объясняется наличием в белках аминокислот, содержащих группировки ароматических соединений. За счет этих группировок при взаимодействии с азотной кислотой образуются ароматические нитросоединения, окрашенные в желтый цвет.Слайд 58 Например, если
в полипептидной цепи белка имеется звено фенилаланина, реакцию можно
представить схемой:…HN CH CO… …NH CH CO …
CH2 C6H5 CH2 C6H4 NO2
звено фенилаланина нитросоединение
Слайд 59
В отличие от биуретовой реакции ксантопротеиновую реакцию дают
не все белки, поскольку в некоторых из них может и не быть α-аминокислот, содержащих группировки ароматических соединений.
Слайд 60
Классификация белков.
Среди белков различают две основные группы веществ:
а) протеины, или простые белки, состоящие только из аминокислот и при гидролизе почти не образующие других продуктов;б) протеиды, или сложные белки, состоящие из собственно белковой части, построенной из α-аминокислот, и из соединенной с ней небелковой части, иначе называемой простетической группой; при гидролизе эти белки кроме α-аминокислот образуют и другие вещества: углеводы, фосфорную кислоту, гетероциклические соединения и т.п.
Слайд 61 Среди протеинов выделяют
несколько подгрупп, отличающихся преимущественно по растворимости.
Протеиды подразделяют на подгруппы в зависимости от характера простетической группы, отщепляющейся при гидролизе от собственно белковой части.Слайд 62 Белковые вещества
классифицируются также по форме их молекул:
а) фибриллярные (волокнистые) белки, молекулы которых имеют нитевидную форму; к ним относят фиброин шелка, кератин шерсти;б) глобулярные белки, молекулы которых имеют округлую форму; к ним относятся, например, альбумины, глобулины и ряд других, в том числе и сложные белки.
Слайд 63
Ароматические амины
Производные
ароматических углеводородов, содержащие в бензольном ядре взамен атома водорода
остаток аммиака – аминогруппу, представляют собой ароматические амины. Подобно аминам жирного ряда, ароматические амины можно рассматривать как производные аммиака, в котором атомы водорода замещены углеводородными радикалами, но, по крайней мере, один из этих радикалов является ароматическим.
Слайд 64
Номенклатура и изомерия
Для многих ароматических аминов употребительны тривиальные названия.
Простейший ароматический амин – производное бензола – анилин:C6H5 NH2 или NH2
анилин (фениламин)
Систематическое название анилина фениламин (фенил – одновалентный радикал бензола).
Слайд 65 Простейшими гомологами
анилина являются аминопроизводные толуола
CH3
C6H4 NH2, называемые толуидинами; они существуют в виде орто-, мета- и пара-изомеров:CH3 CH3 CH3
NH2
NH2
NH2
о-толуидин м- толуидин n- толуидин
(о-толиламин) (м-толиламин) (n-толиламин)
Слайд 66 Толуидины по названию
радикалов толуола можно назвать о-, м- и n-толиламинами.
Ароматические амины, в которых, как в анилине, толуидинах, азот аминогруппы соединен только с одним ароматическим радикалом, являются первичными аминами; вторичные и третичные амины содержат в соединении с азотом соответственно два или три радикала и могут быть двух типов:Слайд 67 а) жирно-ароматические –
содержат в соединении с азотом не только ароматический, но
и алкильные радикалы, например: CH3NH CH3 N
CH3
N- метиламин N,N - диметиланилин
(вторичный амин) (третичный амин)
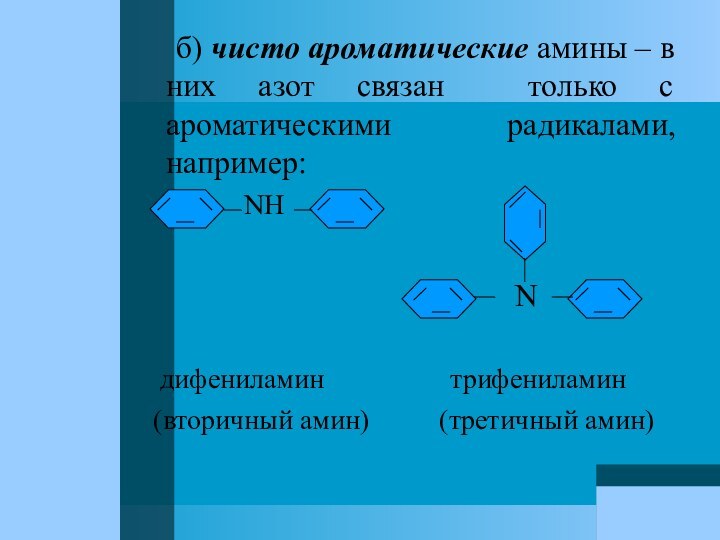
Слайд 68 б) чисто ароматические амины
– в них азот связан только с ароматическими радикалами,
например:NH
N
дифениламин трифениламин
(вторичный амин) (третичный амин)
Слайд 69
Химические свойства
Реакции за счет аминогруппы
Подобно аминам жирного ряда, ароматические амины проявляют
свойства оснований и с кислотами образуют соли замещенного аммония. Например:C6H5NH2 + HCl [ C6H5NH3 ] Cl
хлорид
фениламмония
C6H5NH2 + H2SO4 [ C6H5NH3 ]2 SO4
сульфат
фениламмония
Слайд 70 Основные свойства
у ароматических аминов гораздо менее выражены, чем у аминов
жирного ряда, что объясняется влиянием бензольного кольца. Водный раствор анилина C6H5NH2 не показывает щелочной реакции на лакмус. Его соли с соляной или серной кислотой сильно гидролизуются, растворы этих солей в воде имеют кислую реакцию и окрашивают лакмус в красный цвет, так как они представляют собой растворы солей слабых оснований и сильных кислот.
Слайд 71
Реакции с азотистой кислотой
Первичные ароматические амины
в реакции с азотистой кислотой (HNO2) отличаются от первичных аминов жирного ряда. Если на соль первичного ароматического амина подействовать на холоду азотистой кислотой, то образуется диазосоединение+ +
NH3 Cl¯+ O = N OH N ≡ N Cl ¯
+ 2H2O
соль анилина азотистая диазосоединение
кислота (соль диазония)
Вторичные ароматические амины, подобно аминам жирного ряда, с азотистой кислотой образуют нитрозамины.
Слайд 72 Третичные ароматические
амины, в отличии от третичных аминов жирного ряда, взаимодействуют
с азотистой кислотой. Третичная аминогруппа проявляет себя как заместитель I рода, поэтому остаток азотистой кислоты – нитрозогруппа – легко замещает водород в бензольном ядре в пара - положении к аминогруппе:(CH3)2 N H+HONO (CH3)2 N
+ NO+H2O
Слайд 73
Реакции за счет
ароматического ядра
Аминогруппа как заместитель I рода облегчает реакции замещения
в бензольном ядре; при этом замещающие группы ставятся в орто- и пара-положения к аминогруппе. Например, при действии бромной воды из анилина получается 2,4,6 – триброманилин:NH2 NH2
Br Br
+ 3 Br2 + 3HBr
Br анилин 2,4,6 – триброманилин
Слайд 74
Действие окислителей.
Под
влиянием аминогруппы бензольное ядро теряет устойчивость к действию окислителей,
и ароматические амины легко окисляются. Например, окисляя анилин (хромовой смесью K2Cr2O7 + H2SO4), получают хинон:NH2 O
+ NH3
O
анилин хинон
Слайд 75
Способы получения ароматических аминов
Наибольший интерес представляет метод синтеза первичных ароматических
аминов путем восстановления нитросоединений (реакция Зинина)NO2 NH2 + 2H2O
нитробензол анилин
Слайд 76
Ароматические диазосоединения
и азосоединения (азокрасители)
Среди производных первичных ароматических аминов одними из наиболее
важных являются диазосоединения и азосоединения. И те и другие содержат двухвалентную группу из двух атомов азотаN = N , называемую азогруппой.
Слайд 77 В диазосоединениях азогруппа
связана только с одним ароматическим углеводородным радикалом (Ar) и
с какой-нибудь группой, присоединенной не через углеродный атом, например, с гидроксильной (OH). В азосоединениях азогруппа непосредственно связана с двумя ароматическими углеводородными радикалами:Ar N = N OH Ar N = N Ar
диазосоединение азосоединение
Слайд 78 Диазосоединения существуют в нескольких
формах, легко превращающихся одна в другую. Вещества,
отвечающиеформуле Ar N = N OH, называются диазогидроксидами, они обладают амфотерными свойствами. При взаимодействии с кислотами диазогидроксиды ведут себя как основания и образуют соли диазония:
+
Ar N = N OH + HCl Ar N N Cl¯ + H2O
диазогидроксид соль диазония
Слайд 79 Под действием
щелочей соли диазония вновь переходят в диазогидроксиды:
+ Ar N N Cl¯ + NaOH Ar N = N OH + HCl
соль диазония диазогидроксид
Простейшее ароматическое диазосоединение является производным бензола. Соответствующая соль диазония, существующая в солянокислой среде, называется хлоридом бензолдиазония (это соединение называют также хлоридом фенилдиазония).
Слайд 80 Простейшее ароматическое
диазосоединение является производным бензола. Соответствующая соль диазония, существующая в
солянокислой среде, называется хлоридом бензолдиазония (это соединение называют также хлоридом фенилдиазония).Слайд 81 Образование
этой соли под действием соляной кислоты и обратный переход
в диазогидроксид под влиянием щелочи можно представить схемойN = N OH N+ N Cl¯
NaOH
диазогидроксид хлорид бензолдиазония
Соли диазония – наиболее важная форма диазосоединений.
Слайд 82
Получение ароматических диазосоединений
Диазосоединения
получаются при диазотировании первичных ароматических аминов, т.е. при действии
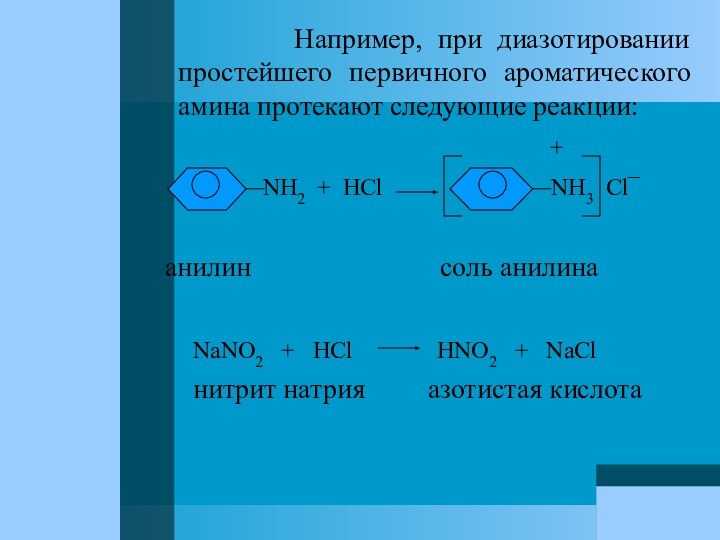
на них азотистой кислоты. Так как азотистая кислота в свободном виде неустойчива, то обычно к раствору амина в избытке соляной кислоты прибавляют раствор соли азотистой кислоты – нитрита натрия NaNO2. Нитрит натрия разлагается соляной кислотой и выделяющаяся азотистая кислота HNO2 сразу же взаимодействует с амином. В этих условиях диазосоединения образуются в виде солей диазония, с которыми обычно имеют дело при практическом использовании диазосоединений.Слайд 83 Например,
при диазотировании простейшего первичного ароматического амина протекают следующие реакции:
+
NH2 + HCl NH3 Cl¯
анилин соль анилина
NaNO2 + HCl HNO2 + NaCl
нитрит натрия азотистая кислота
Слайд 84
+
NH3 Cl¯ + HO N = O N ≡ N Cl¯+
+H2O
соль анилина азотистая диазосоединение
кислота (соль диазония)
Диазотирование ведут при охлаждении, так как диазосоединения нестойки.
Слайд 85
Химические свойства диазосоединений
Соли
диазония – весьма реакционноспособные вещества. Используя их как промежуточные
продукты, из первичных аминов можно получать разнообразные органические соединения. Различают два типа превращений диазосоединений:
Слайд 86
Реакции, протекающие с выделением азота.
Диазосоединения неустойчивы; в кислом растворе уже при слабом
нагревании или под действием света они гидролизуются, выделяя азот, и превращаются в фенолы:+
N ≡ N Cl ¯ + HOH OH+
+ N2 +HCl
диазосоединение фенол
Слайд 87 Если соль диазония
– хлорид, бромид или иодид – нагревать с соответствующей
солью меди (CuCl, CuBr, CuJ), реакция протекает также с выделением азота. Вместо диазогруппы в бензольное ядро вводится галоген – образуются ароматические галогенпроизводные. Например:+
N ≡ N Cl ¯ Cl + N2
хлорид бензолдиазония хлорбензол
Слайд 88
Реакции, протекающие без выделения азота.
Среди реакций
этого типа наиболее важны реакции взаимодействия солей диазония с фенолами и ароматическими аминами, приводящие к образованию азосоединений (азокрасителей).Простейшими азосоединениями является азобензол – вещество, в котором азогруппа
( N = N ) соединена с двумя остатками бензола:
N = N
Огромное значение имеют азосоединения, содержащие в ароматических ядрах гидроксильные группы или аминогруппы; они представляют собой большой класс красящих веществ, называемых азокрасителями.
Слайд 89
Получение азосоединений
Азосоединения
получают при взаимодействии солей диазония с фенолами или ароматическимим
аминами; эту реакцию называют реакцией азосочетания. Например, при сочетании диазосоединения из анилина с фенолом образуется азокраситель оранжевого цвета.+
N ≡ N Cl¯ + H OH
диазосоединение фенол
из анилина
N = N OH + HCl
азокраситель
(гидроксиазосоединение)
Слайд 90 Если
то же диазосоединение взаимодействует с диметиланилином (ароматическим амином), то
получается азокраситель желтого цвета.С фенолами азосочетание ведут в щелочной среде, а с аминами в слабокислой или нейтральной.
Исходный для получения азокрасителей первичный ароматический амин, который путем диазотирования превращают в диазосоединение, называется диазосоставляющей, а фенол или амин, вводимый в азосочетание, – азосоставляющей красителя.
Слайд 91 Полная схема синтеза
азокрасителя (азосоединения), известного под названием паракрасный. В качестве диазосостаавляющей
берется n -нитроанилин, а в качестве азосоставляющей – β-нафтол.1) диазотирование +
O2N NH2 O2N NH3 Cl¯
n-нитроанилин соль нитроанилина
+ _
O2N N ≡ N Cl + 2H2O
диазосоединение
хлорид п-нитробензолдиазония
Слайд 92
2) азосочетание
OH
+
O2N N ≡ N Cl¯ + H
β-нафтол (азосоставляющая)
OH
O2N N = N + HCl
азокраситель (паракрасный)
β-нафтол вступает в азосочетание за счет водорода в орто-положении к группе OH (заместителю I рода) (α-нафтол сочетается за счет водорода в пара положении к группе OH).





























