степеней окисления химических элементов, образующих вещества
По тепловому эффекту
По агрегатному
состоянию веществПо участию катализатора
По направлению
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть




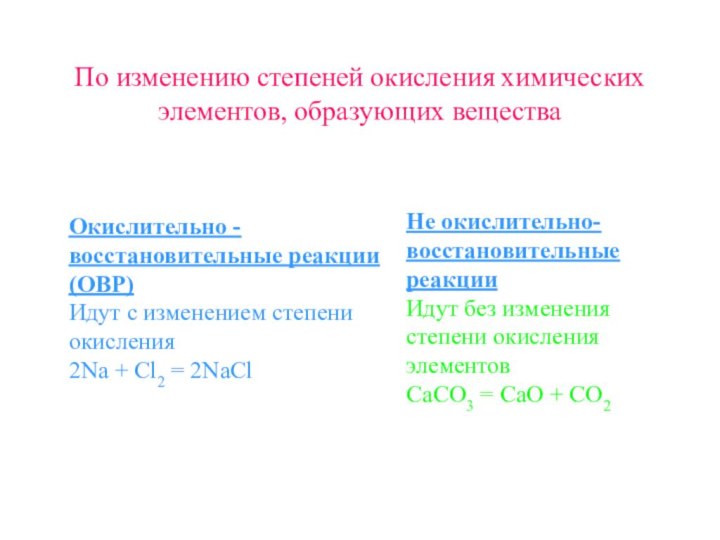







Не окислительно-восстановительные реакции
Идут без изменения степени окисления элементов
CaCO3 = CaO + CO2
Гетерогенные
Реакция идет на поверхности раздела фаз (т-г, т-ж, ж-г, т-т)
С + О2 = СО2
т г г
Некаталитические
Реакции, которые идут без участия катализатора
Zn + 2HCl = ZnCl2 + H2
Обратимые
Идут одновременно в двух противоположных направлениях
N2 + 3H2↔2NH3 + Q