- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Чугуны. Классификация
Содержание
- 2. Металлы – это химические элементы, атомы которых
- 3. Щелочные: Щёлочноземельные: Переходные:Литий
- 4. МеталлыЧерные
- 5. Распространенность металлов в природеМногие металлы широко распространены в природе.Содержание некоторых элементов металлов в земной коре:Алюминий-8,2%Железо-5,0%Кальций-4,1%Натрий-2,3%Магний-2,3%Калий-2,1%
- 6. Большое количество натрия и магния содержится в
- 7. Нахождение металлов в природе
- 8. +++++Кристаллическая решетка металлаСтроение металлов, особая металлическая связь
- 9. Особенности в строении атомов металлов:На внешней оболочке
- 10. Характерные свойства металловМеталлический блеск (кроме йода. Несмотря
- 11. Физические свойства металловВсе металлы (кроме ртути) тверды
- 12. Механические свойства металловЭто способность металлов подвергаться различным
- 13. Общие химические свойства металловЭлектрохимический ряд напряжений металлов:
- 14. Взаимодействие с простыми веществами-неметаллами1.С кислородом 2.С галогенами 3.С водородом 4.С серой 5.С азотом
- 15. Взаимодействие со сложными веществами1.С водой 2.С кислотами
- 16. Применение металлов в
- 18. Способы получения металловМеталлургия – это и наука
- 19. МеталлургияОтрасль промышленности, которая занимается получением металлов из
- 20. Минералы и горные породы, содержащие
- 21. Гидрометаллургия – это восстановление металлов из их
- 22. К металлам относится такое понятие как металлическая
- 23. Взаимодействие с магнитным полем1.Ферромагнетики (сильно намагничиваются)2.Парамагнетики (слабо намагничиваются)3.Диамагнетики (выталкиваются магнитным полем)
- 24. Коррозия – это процесс самопроизвольного разрушения металлов
- 25. Виды коррозии1.Химическая коррозия (происходит в не проводящей
- 26. Способы защиты от коррозииШлифование поверхностей изделия при
- 27. Нанесение защитных покрытийНеметаллические (масла, лаки, краски)Химические (искусственно
- 28. Скачать презентацию
- 29. Похожие презентации
Металлы – это химические элементы, атомы которых отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы.


























Слайд 3
Щелочные: Щёлочноземельные: Переходные:
Литий
Кальций
ЖелезоНатрий Стронций Платина
Калий Барий Медь
Рубидий Цинк
Цезий Золото
Серебро
Палладий
Ртуть
Никель
Кобальт
Другие: Алюминий, Свинец, Олово
Разновидность металлов.
Слайд 5
Распространенность металлов в природе
Многие металлы широко распространены в
природе.
Содержание некоторых элементов металлов в земной коре:
Алюминий-8,2%
Железо-5,0%
Кальций-4,1%
Натрий-2,3%
Магний-2,3%
Калий-2,1%
Слайд 6 Большое количество натрия и магния содержится в морской
воде: — 1,05%, — 0,12%. В природе металлы встречаются в
различном виде: — в самородном состоянии: серебро , золото , латина , медь , иногда ртуть.— в виде оксидов
— в виде смешанных оксидов
— различных солей
Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные. Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий.
Слайд 8
+
+
+
+
+
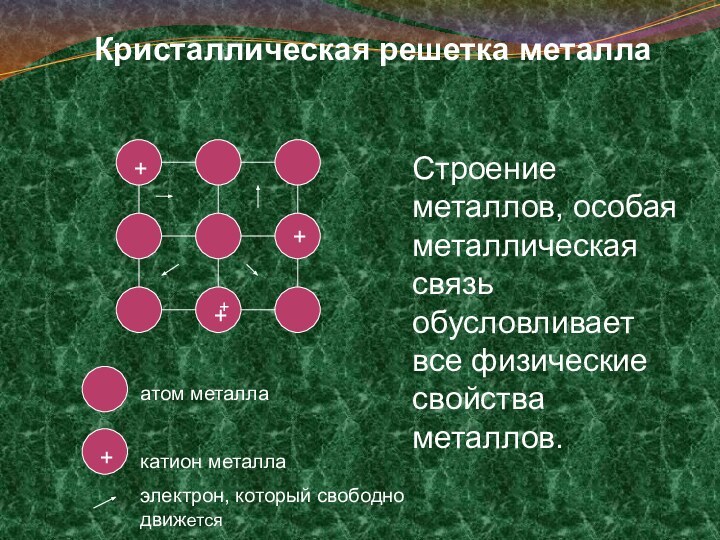
Кристаллическая решетка металла
Строение металлов, особая металлическая связь обусловливает
все физические свойства металлов.
атом металла
катион металла
электрон, который свободно движется
Слайд 9
Особенности в строении атомов металлов:
На внешней оболочке 1-3
электрона, редко 4.
Имеют относительно большие радиусы.
В химических реакциях электроны
отдают,Металлы являются восстановителями, а сами при этом окисляются.
Na – 1e- = Na+
Ca – 2e- = Ca2+
Al – 3 e- = Al3+
Слайд 10
Характерные свойства металлов
Металлический блеск (кроме йода. Несмотря на
свой металлический блеск, кристаллический йод относится к неметаллам).
Хорошая
электропроводность Возможность лёгкой механической обработки (например, пластичность)
Высокая плотность
Высокая температура плавления
Большая теплопроводность
В реакциях являются восстановителями
Слайд 11
Физические свойства металлов
Все металлы (кроме ртути) тверды при
нормальных условиях. Температуры плавления лежат в диапазоне от −39
°C (ртуть) до 3410 °C (вольфрам). В зависимости от их плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³).
Слайд 12
Механические свойства металлов
Это способность металлов подвергаться различным способам
механической обработки:
Литью
Ковке
Вальцеванию
Вытягиваню в проволоку
Гибке
Сварке
Пайке
Обтачиванию
Сверлению
Пилению
Строганию
Обработке на станках
и др.
Слайд 14
Взаимодействие с простыми веществами-неметаллами
1.С кислородом
2.С галогенами
3.С
водородом
4.С серой
5.С азотом
Слайд 15
Взаимодействие со сложными веществами
1.С водой
2.С кислотами в
растворе
3.С солями менее активных металлов в растворе
4.С
органическими веществами 5.Со щелочами в растворе
6.Интермические соединения – химические соединения металлов друг с другом
Слайд 16 Применение металлов в жизни
человека
В медицине благородные металлы применяют для изготовления инструментов, деталей
приборов, протезов, а также различных препаратов, главным образом на основе серебра. Сплавы платины с иридием, палладием и золотом почти незаменимы при изготовлении игл для шприцев. Из медицинских препаратов, содержащих благородных металлов, наиболее распространены ляпис, протаргол и др. Благородные металлы применяют при лучевой терапии (иглы из радиоактивного золота для разрушения злокачественных опухолей), а также в препаратах, повышающих защитные свойства организма.Слайд 17
Железо.
Металлы составляют одну из основ цивилизации
на планете Земля. Среди них как конструкционный материал явно выделяется железо. Объем промышленного производства железа примерно в 20 раз больше, чем объем производства всех остальных металлов, вместе взятых. Широкое внедрение железа в промышленное строительство и транспорт произошло на рубеже XVIII...XIX вв. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Однако начало практического использования человеком железа относят к IX в. до н.э. Именно в этот период человечество из бронзового века перешло в век железный В природе, хотя и очень редко, но встречается самородное железо. Его происхождение считают метеоритным, т.е. космическим, а не земным. Поэтому первые изделия из железа (они изготавливались из самородков) ценились очень высоко – гораздо выше, чем из серебра и даже золота.
Слайд 18
Способы получения металлов
Металлургия – это и наука о
промышленных способах получения металлов из руд, и отрасль промышленности.
Пирометаллургия
– восстановление металлов из руд при высоких температурах с помощью углерода, оксида углерода(II), водорода, металлов – алюминия, магния.
Слайд 19
Металлургия
Отрасль промышленности, которая занимается получением металлов из руд.
Металлурги́я
(от греч. metallurgéo — добываю руду, обрабатываю металлы, от
métallon — рудник, металл и érgon — работа)Наука о промышленных способах получения металлов из руд.
Искусство извлечения
металлов из руд
Рис. 1. Плавка металла в Древнем Египте (дутьё подаётся мехами, сшитыми из шкур животных).
Слайд 20
Минералы и горные породы,
содержащие металлы
или их соединения
и пригодные для промышленного
получения металлов,
называются рудами
Слайд 21 Гидрометаллургия – это восстановление металлов из их солей
в растворе.
Процесс происходит в два этапа:
1.природное соединение
растворяют в подходящем реагенте для получения раствора соли этого металла.2.из полученного раствора данный металл вытесняют более активным или восстанавливают гидролизом.
Электрометаллургия – восстановление металлов в процессе растворов или расплавов их соединений.
Слайд 22 К металлам относится такое понятие как металлическая связь
–
это связь в металлах и сплавах между атом-ионами металлов,
расположенными в узлах кристаллической решётки, которая осуществляется обобществлёнными валентными электронами.Металлическая связь
Слайд 23
Взаимодействие с магнитным полем
1.Ферромагнетики (сильно намагничиваются)
2.Парамагнетики (слабо намагничиваются)
3.Диамагнетики
(выталкиваются магнитным полем)
Слайд 24
Коррозия
– это процесс самопроизвольного разрушения металлов и
сплавов под влиянием внешней среды.
Приводит к уменьшению надёжности работы
металлоконструкций.Наносит большой экономический вред.
Приводит к простоям производства из-за замены вышедшего из строя оборудования.
Может привести к загрязнению продукции.
Слайд 25
Виды коррозии
1.Химическая коррозия (происходит в не проводящей электрический
ток среде, при взаимодействии металлов с сухими газами и
жидкостями)2.Электрохимическая коррозия (происходит в токопроводящей среде, при контакте примесей, содержащихся в металлах и сплавах, с электролитами)
Слайд 26
Способы защиты от коррозии
Шлифование поверхностей изделия при проэктировании
металлических конструкций и их изготовлении , чтобы на них
не засиживалась влагаПрименение легированных сплавов, содержащих специальные добавки: хром, никель.
Специальная обработка электролита или другой среды, в которой находится защищаемая металлическая конструкция.
Слайд 27
Нанесение защитных покрытий
Неметаллические (масла, лаки, краски)
Химические (искусственно созданные
поверхностные плёнки)
Металлические (покрытия другими металлами)
Электрохимические методы защиты
Протекторная
Катодная





























