Слайд 2
Цель урока:
рассмотреть гомологический ряд предельных УВ,
строение молекул алканов.
ознакомить учащихся с изомерией предельных УВ.
физическими свойствами и основными способами получения.
Слайд 3
уравнения химических реакции горения
CH4 +2O2 → 2H2O
+ CO2↑
2C2H6 +7O2 → 6H2O + 4CO2↑
C3H8 +5O2 →
4H2O + 3CO2↑
2C4H10 +13O2 → 10H2O + 8CO2↑
C5H12 +8O2 → 6H2O + 5CO2↑
2C6H14 +19O2 → 14H2O + 12CO2↑
Слайд 4
Определение алканов
Это предельные углеводороды, в молекулах которых все
атомы связаны одинарными связами
Слайд 5
Общая формула алканов
Сn H2n+2
Слайд 6
Гомологический ряд
СН4 метан
С2Н6 этан
С3Н8 пропан С4Н10 бутан
С5Н12 пентан С6Н14 гексан
С7Н16 гептан С8Н18 октан
С9Н20 нонан С10Н22 декан
Слайд 7
Название радикалов
CH3 метил
C2H5
этил
C3H7
пропил
C4H9 бутил
C5H11 пентил
C6H13 гексил
Слайд 8
Физические свойства
С1 – С4 – газы,
С5 –С15
– жидкости,
С16 - ∞ -твердые вещества
Газы и
твердые алканы запаха не имеют, жидкие имеют бензиновый запах. Легче воды. Плохо растворимы в воде
Слайд 9
Строение алканов
Молекула первого члена гомологического ряда алканов –
метан имеет тетраэдрическое строение.
Все атомы углерода в молекулах
алканов находятся в состоянии sp3 гибридизации Угол между связами составляет109 28 длина связи С — С в предельных углеводородах 0,154 нм.
Слайд 10
Пространственное строение метана
Слайд 11
Виды изомерии
Структурная
Углеродного скелета
Положения
кратной связи
Положения функциональной группы
Межклассовая
Слайд 12
Алгоритм составления названия алканов
1.В структурной формуле выбирают
самую длинную цепь атомов углерода (главную цепь)
2.Атомы углерода главной
цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
3.В начале названия перечисляют радикалы и другие заместители с указанием номеров атомов углерода ,с которыми они связаны. Если в молекуле присутствует несколько одинаковых радикалов (два, три, четыре и т. д) то цифрой указывают место каждого из них в главной цепи и перед их названием ставят соответственно частицы ди-, три-, тетра- и т.д.
4.Основой названия служит наименование предельного углеводорода с тем же числом атомов углерода, что и в главной цепи.
Слайд 13
Дать название алканам
CH3
1 ǀ2 3
CH3 − C − CH3
ǀ
CH3
2,2-диметилпропан
Слайд 14
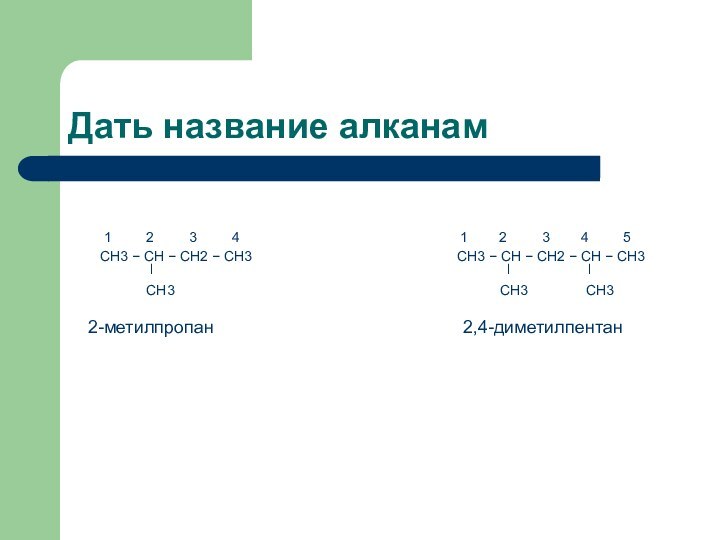
Дать название алканам
1
2 3
4 1 2 3 4 5
CH3 − CH − CH2 − CH3 CH3 − CH − CH2 − CH − CH3
ǀ ǀ ǀ
CH3 CH3 CH3
2-метилпропан 2,4-диметилпентан
Слайд 15
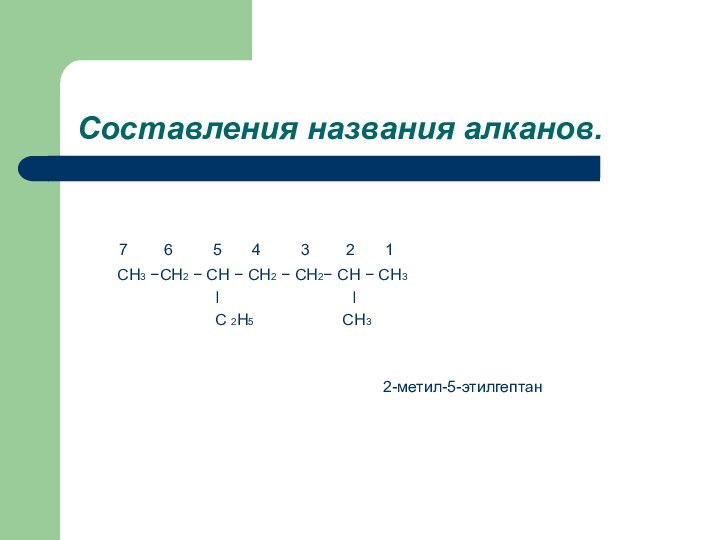
Составления названия алканов.
7
6 5
4 3 2 1
CH3 −CH2 − CH − CH2 − CH2− CH − CH3
ǀ ǀ
C 2H5 CH3
2-метил-5-этилгептан
Слайд 16
Получение алканов.
Получение метана
1.В п р
о м ы ш л е н н о
с т и:
а)из природного газа
б)синтез из оксида углерода (II) и водорода
Ni,300˚C
CO + 3H2 → CH4 ↑ +H2O
Слайд 17
Получение метана
В л а б о р
а т о р и и
а)гидролиз карбида алюминия
Al4C3 +12H2O → 3CH4 ↑ +4Al(OH)3
б )сплавление солей уксусной кислоты со щелочами
CH3COONa +NaOH (т) → CH4 ↑ +Na2CO3
Слайд 18
Получение гомологов метана.
В
п р о м ы ш л е
н н о с т и
а) из природного сырья (нефть, газ, горный воск)
б) синтез из оксида углерода (II) и водорода
Слайд 19
Получение гомологов метана.
В л а б о р
а т о р и и
а)каталитическое гидрирование непредельных углеводородов (алкенов,алкинов)
Pt
CnH2n + H2 → CnH2n+2
Ni,150˚C
CnH2n-2 + 2H2 → CnH2n+2
б) взаимодействие галогеноалканов с натрием (реакция Вюрца)
2R−Br +Na → R−R + 2NaBr
2CH3Br + Na → CH3 − CH3 +2NaBr