- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Дисперсные системы. Коллоидные растворы
Содержание
- 2. Коллоидная химия – наука, изучающая физико-химические свойства гетерогенных, высоко-дисперсных систем и ВМС (высоко-молекулярных соединений).Томас Грэм (1862)
- 3. ДИСПЕРСНАЯ СИСТЕМА – Дисперсная фаза ( Д.Ф.) - Дисперсионная среда ( Д.С.) -
- 4. Классификация дисперсных систем
- 5. II. По степени дисперсности дисперсной фазы1. Грубодисперсные
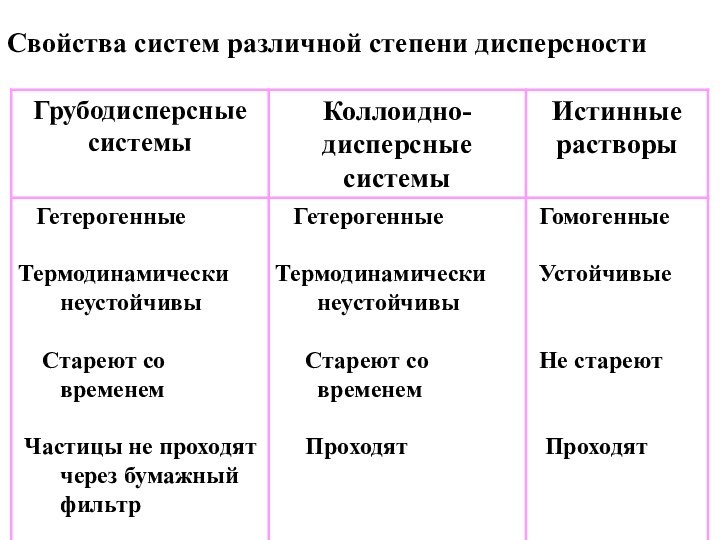
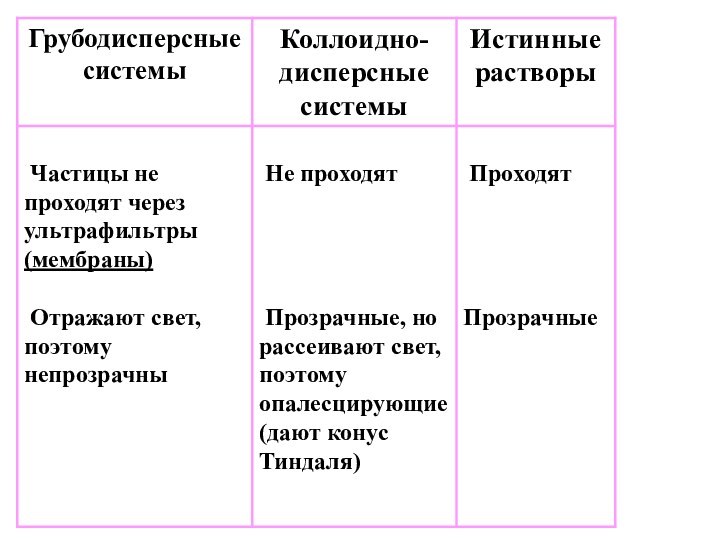
- 6. Свойства систем различной степени дисперсности
- 8. МЕТОДЫ ПОЛУЧЕНИЯ КОЛЛОИДНЫХ РАСТВОРОВ:I. Методы диспергирования: -
- 9. II. Методы конденсациифизические методы:а - метод замены
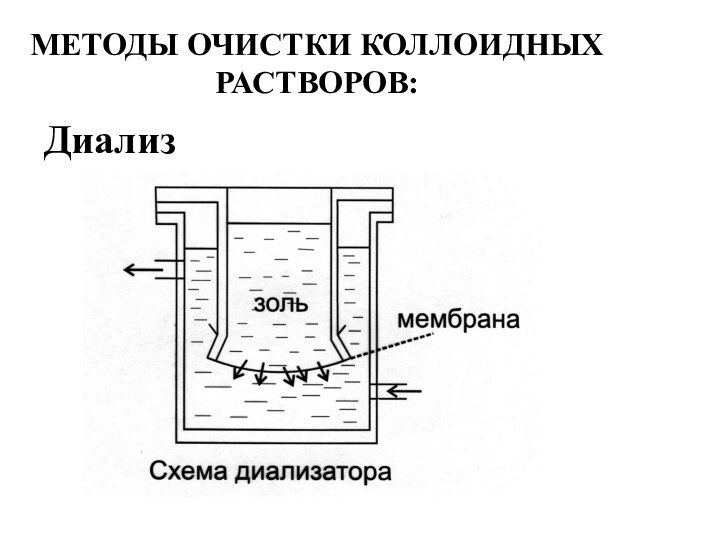
- 10. МЕТОДЫ ОЧИСТКИ КОЛЛОИДНЫХРАСТВОРОВ:Диализ
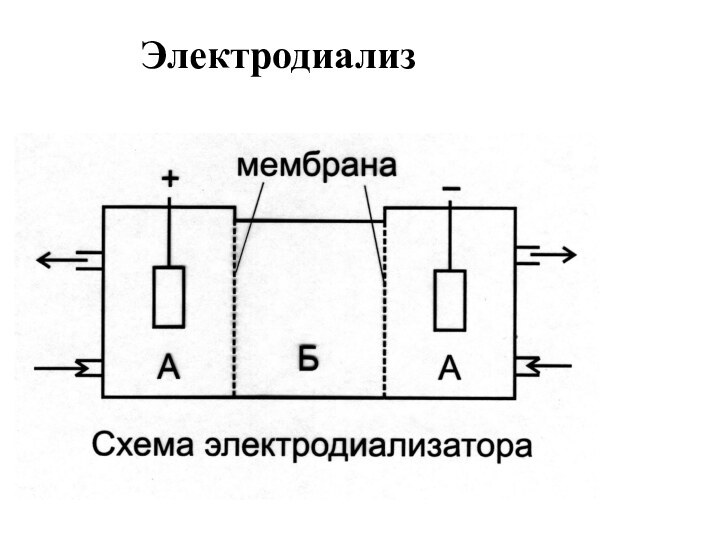
- 11. Электродиализ
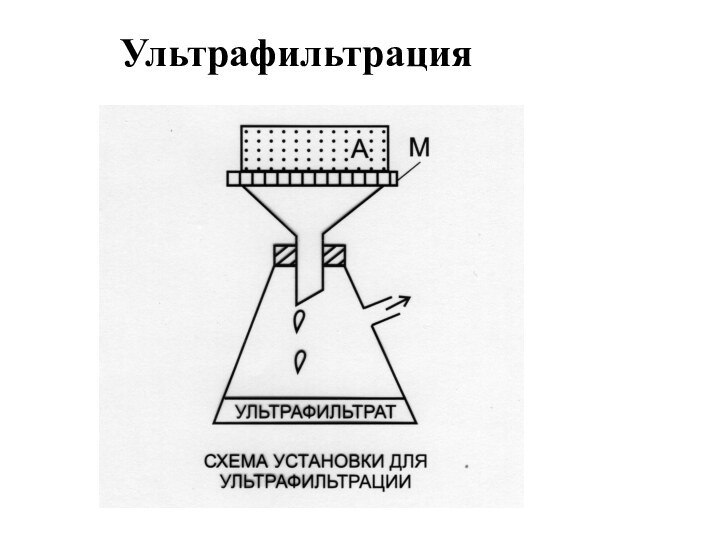
- 12. Ультрафильтрация
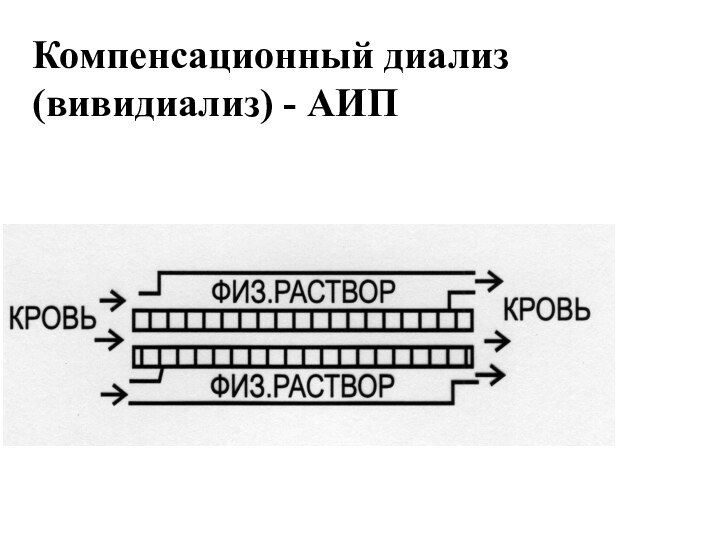
- 13. Компенсационный диализ (вивидиализ) - АИП
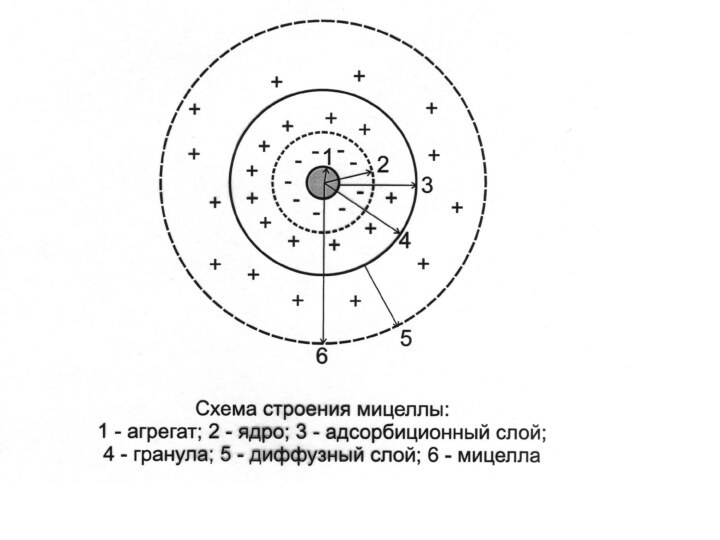
- 14. МИЦЕЛЛА (Лат. Mica -крошка) - это отдельная
- 15. Ядро состоит из агрегата (микрокристаллы
- 16. Правило ПАНЕТТА-ФАЯНСА:кристаллическую решетку ядра достраивает тот ион,
- 18. Условия получения золя: 1. плохая
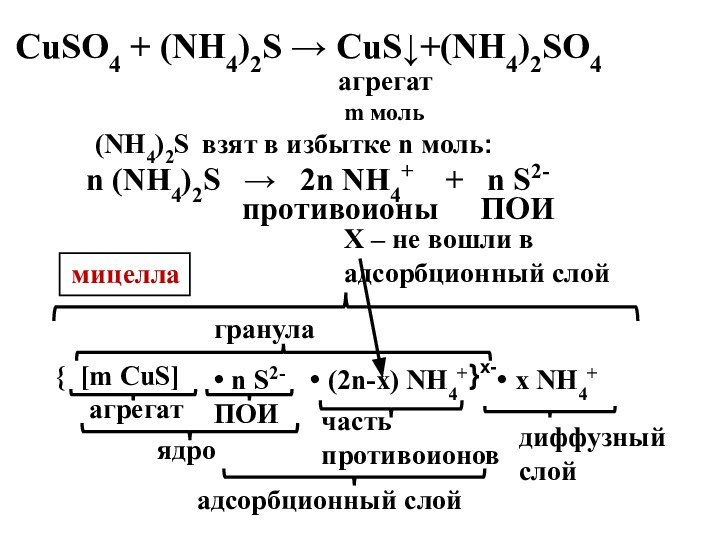
- 19. агрегат m моль(NH4)2S взят в избытке n
- 20. СuSO4 взят в избытке n моль;n СuSO4
- 21. В мицелле существует 2 скачка потенциала:
- 22. Устойчивость коллоидных растворов:Седиментационная (кинетическая) устойчивость
- 23. II. Агрегативная устойчивость –
- 24. Основные факторы устойчивости коллоидных растворов1. Величина ζ-потенциала
- 25. КОАГУЛЯЦИЯ - процесс укрупнения частиц дисперсной фазы
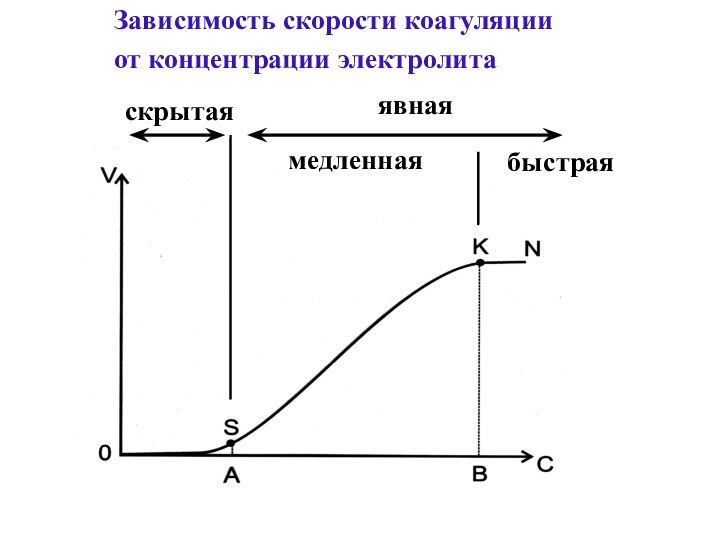
- 26. Зависимость скорости коагуляции от концентрации электролитаскрытаяявнаямедленнаябыстрая
- 27. Порог коагуляции - наименьшее количество
- 28. Правило Шульце-Гарди: Для
- 29. Р(Al+3) : Р(Ca+2) : Р(K+1) ≈Гранула
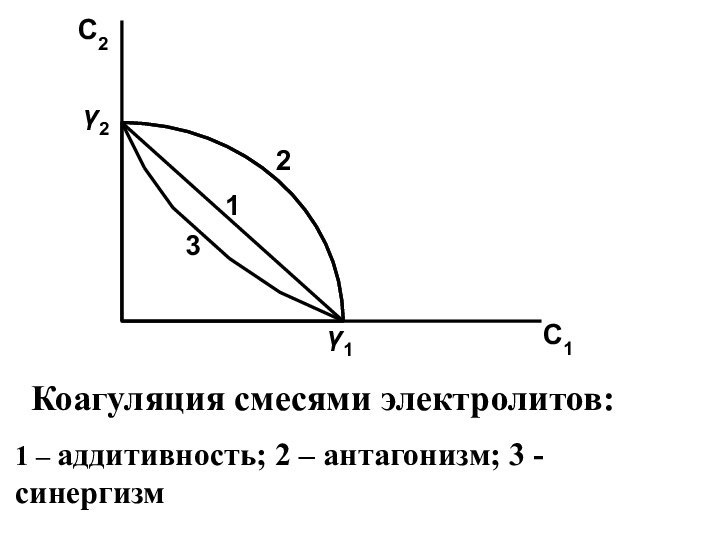
- 30. При коагуляции смесями электролитов возможны 3 случая:
- 31. C2C1213γ2γ1 Коагуляция смесями электролитов:1 – аддитивность; 2 – антагонизм; 3 - синергизм
- 32. Механизм коагуляции золей электролитами1. Сжатие диффузного слоя2.
- 33. Скачать презентацию
- 34. Похожие презентации























Слайд 2 Коллоидная химия – наука, изучающая физико-химические свойства гетерогенных,
высоко-дисперсных систем и ВМС (высоко-молекулярных соединений).
Слайд 5
II. По степени дисперсности
дисперсной фазы
1. Грубодисперсные системы
>10-7
м или >100 нм
2. Коллоидно-дисперсные системы
≈ 10-7 -
10-9 м, 1 - 100 нмМолекулярно-ионные (истинные) растворы:
< 10-9 м, < 1 нм
Слайд 8
МЕТОДЫ ПОЛУЧЕНИЯ
КОЛЛОИДНЫХ РАСТВОРОВ:
I. Методы диспергирования:
-
механическое дробление;
- дробление ультразвуком ;
- электрический
метод ;- метод пептизации.
Слайд 9
II. Методы конденсации
физические методы:
а - метод замены растворителя
б - метод конденсации паров
химические методы:
- реакции восстановления
(Ag2O+H2 → 2Ag↓ +H2O)
- реакции окисления
(2H2S + SO2 → 3S↓ + 2Н2О)
- реакции обмена
(СuСl2+ Na2S → CuS↓ + 2NaCl)
- реакции гидролиза
(FеСl3 +ЗН2O → Fe(OH)3↓ +3HCI)
Слайд 14
МИЦЕЛЛА (Лат. Mica -крошка) -
это отдельная частица
дисперсной фазы коллоидного раствора с жидкой дисперсионной средой.
Мицеллярная
теория строения коллоидных частицСлайд 15 Ядро состоит из агрегата (микрокристаллы малорастворимого
вещества) и потенциалопределяющих ионов (ПОИ).
Мицелла состоит из:
1. ядра;
2. адсорбционного слоя;
3. диффузного слоя.
Слайд 16
Правило ПАНЕТТА-ФАЯНСА:
кристаллическую решетку ядра достраивает тот ион, который
находится в растворе в избытке и содержится в агрегате
или родственен ему.
Слайд 18
Условия получения золя:
1. плохая растворимость
Д.Ф. в Д.С., т.е. наличие
границы раздела фаз;2. размер частиц 10-7 -10-9 м (1-100 нм) ;
3. наличие иона стабилизатора, который сорбируясь на ядре прeпятствует
слипанию частиц (ион-стабилизатор определяется правилом Панетта-Фаянса)
Слайд 19
агрегат
m моль
(NH4)2S взят в избытке n моль:
n
(NH4)2S → 2n NH4+ +
n S2-ПОИ
противоионы
{ [m CuS]
агрегат
• n S2-
ПОИ
ядро
• (2n-x) NH4+
адсорбционный слой
}х-
гранула
• x NH4+
мицелла
часть противоионов
диффузный слой
Х – не вошли в адсорбционный слой
СuSO4 + (NH4)2S → CuS↓+(NH4)2SO4
Слайд 20
СuSO4 взят в избытке n моль;
n СuSO4 →
n Сu2+ + n SO42-
противоионы
ПОИ
{ m (CuS)
агрегат
• n Сu2+
ПОИ
ядро
• (n-x) SO42-
часть противоионов
адсорбционный слой
}
гранула
2x+
• x SO42-
диффузный слой
мицелла
СuSO4 + (NH4)2S → CuS↓+(NH4)2SO4
Слайд 21 В мицелле существует 2 скачка потенциала:
1)
φ - электротермодинамический –φ ~ 1 В.
2) ζ (дзетта) - электрокинетический –
ζ = 0,1 В
Состояние гранулы, когда все ионы диффузного слоя переходят в адсорбционный и ζ = 0 - называется изоэлектрическим.
{[m CuS] • n Сu2+• (n-x) SO4 2-}2x+ • x SO42-
φ
ζ
Слайд 22
Устойчивость
коллоидных растворов:
Седиментационная (кинетическая) устойчивость -
броуновское движение;
степень дисперсности;
3. вязкость дисперсионной среды (чем ↑, тем ↑ уст-сть);
4. температура (чем ↑, тем ↑ уст-сть).
Слайд 23
II. Агрегативная устойчивость –
способность системы противостоять
слипанию частиц дисперсной фазы.
Критерии:1. ионная оболочка, т.е. наличие
двойного электрического слоя; ДЭС = адсорбционный + диффузный слой
2. сольватная (гидратная) оболочка растворителя (чем ↑, тем ↑ уст-сть);
3. величина ζ– потенциала гранулы ( чем > ζ , тем < вероятность слипания и тем > уст-сть)
4. температура.
Слайд 24
Основные факторы устойчивости коллоидных растворов
1. Величина ζ-потенциала
2.
Величина электродинамического потенциала (φ)
3. Толщина диффузного слоя
4. Величина
заряда гранулыСлайд 25 КОАГУЛЯЦИЯ - процесс укрупнения частиц дисперсной фазы золя
с последующим выпадением в осадок.
Факторы, вызывающие коагуляцию:
увеличение концентрации
золя;действие света;
изменение температуры;
облучение;
добавление электролитов.
Слайд 27 Порог коагуляции - наименьшее количество электролита,
которое вызывает явную коагуляцию 1л золя
γ =
C· V / Vоγ - порог коагуляции, моль/л;
С - концентрация электролита, моль/л;
V - объем раствора электролита, л;
Vo - объем золя, л.
Р = 1/ γ - коагулирующая способность электролита
Слайд 28
Правило Шульце-Гарди:
Для разновалентных
ионов их коагулирующее действие прямо пропорционально зарядам ионов в
шестой степени
Слайд 29
Р(Al+3) : Р(Ca+2) : Р(K+1) ≈
Гранула (
- )
36 : 26 : 16 ≈ 729
: 64 : 1γ(Al+3):γ(Ca+2):γ(K+1) ≈ 1/36:1/26:1/16
Гранула ( + )
Р(PO4 3-) : Р(SO42-) : Р(Cl-) ≈ 36 : 26 : 16
γ(PO4 3-): γ(SO42-): γ(Cl-) ≈ 1/36:1/26:1/16





























