Слайд 2
ПАРАДОКС ПРОИСХОЖДЕНИЯ ЖИЗНИ
Для воспроизводства все живые клетки нуждаются
в нуклеиновых кислотах. Следовательно, без нуклеиновых кислот не может
быть жизни.
Все живые клетки нуждаются в белках, необходимых для множества процессов, с помощью которых поддерживается жизнь клетки. Следовательно, без белков не может быть жизни.
Белки производятся только нуклеиновыми кислотами. Значит, без нуклеиновых кислот не может быть белков.
Нуклеиновые кислоты могут воспроизводиться только в присутствии белков. Следовательно, без белков не может быть нуклеиновых кислот.
Слайд 3
Одной из многих важных нерешенных проблем в науке
о происхождении жизни является исходное функциональное соотношение между белками
и нуклеиновыми кислотами — что из них появилось раньше?
Нуклеиновые кислоты не могут воспроизводиться без ферментов [белков], а ферменты не могут образовываться без нуклеиновых кислот.
Слайд 4
«Рисующие руки», по литографии М.С. Эшера
Слайд 5
Области применения ферментов в биологии и медицине (по Грину).
Слайд 6
План:
Ферменты.
Коферменты, простетические группы.
Активный центр, субстратная специфичность
ферментов.
Динамичность фермент - субстратного взаимодействия.
Классификация и номенклатура.
Активаторы и
ингибиторы.
Регуляция активности ферментов.
Слайд 7
ФЕРМЕНТЫ (энзимы) - это высокоспецифичные белки,
выполняющие функции биологических катализаторов.
Катализатор - это вещество,
которое ускоряет химическую реакцию, но само в ходе этой реакции не расходуется.
Слайд 8
Отличия ферментов от небиологических катализаторов:
Высокая эффективность действия
Специфичность
действия
Способность к регуляции
Слайд 9
Сложные ферменты:
Белковая часть (апофермент) обеспечивает связывание субстрата, а
катализ осуществляют небелковые (мономерные) соединения, называемые кофактором.
Комплекс апофермента и
кофактора называется холоферментом.
Кофакторами могут быть ионы металлов (Zn2+, Mg2+, Mn2+, Fe2+, K+, Na+) или органические соединения, которые обычно называют коферментами. Большинство из них являются производными витаминов.
Слайд 10
Некоторые коферменты и их функции
Слайд 11
Тип связи между ферментом и коферментом
может быть различным:
Иногда связь слабая и возникает только во
время протекания реакции
В других случаях кофактор и фермент прочно соединены ковалентными связями. В этом случае небелковую часть фермента называют простетической группой.
Слайд 12
Функции кофакторов:
Участвуют в формировании третичной структуры белка и
обеспечении комплементарности между ферментом и субстратом.
Могут непосредственно вовлекаться в
реакции в качестве еще одного субстрата. В этой роли обычно выступают органические коферменты – они выступают как доноры или акцепторы определенных химических групп.
Слайд 13
СТРОЕНИЕ ФЕРМЕНТОВ
Субстрат (S) - вещество, химические
превращения которого в продукт (Р) катализирует фермент (Е).
Активный центр фермента - тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата.
Слайд 14
АКТИВНЫЙ ЦЕНТР ФЕРМЕНТА
Активный центр фермента образован из остатков
аминокислот, находящихся в составе различных участков полипептидной цепи или
различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента.
В его пределах различают адсорбционный центр и каталитический центр.
Вне активного центра фермента встречаются особые функциональные участки, каждый из них обозначают термином аллостерический центр.
Слайд 15
КАТАЛИТИЧЕСКИЙ ЦЕНТР
Это та область (зона) активного центра фермента,
которая непосредственно формируется за счет радикалов двух, иногда
трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи.
Каталитический центр "серин-гистидиновых" ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент).
Слайд 16
АДСОРБЦИОННЫЙ ЦЕНТР
Участок активного центра молекулы фермента, на
котором происходит сорбция (связывание) молекулы субстрата.
Он формируется одним,
двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром.
Главная его функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра).
Слайд 17
Эта сорбция происходит только за счет
слабых типов связей и потому является обратимой.
По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями.
Слайд 18
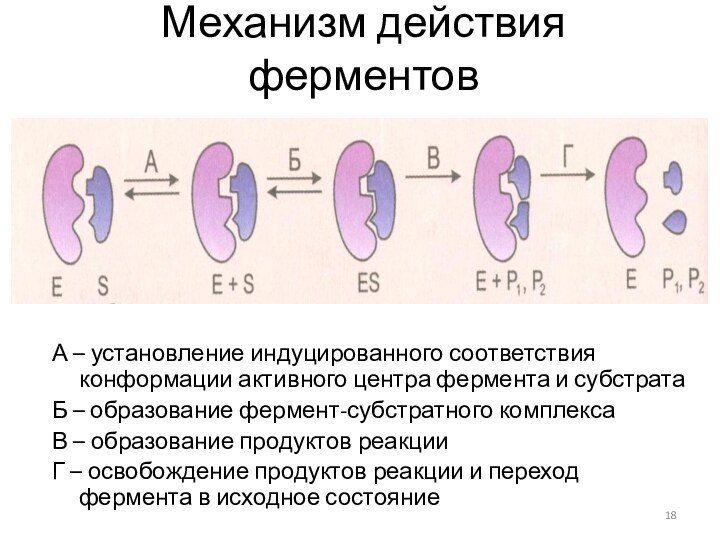
Механизм действия ферментов
А – установление индуцированного соответствия конформации
активного центра фермента и субстрата
Б – образование фермент-субстратного комплекса
В
– образование продуктов реакции
Г – освобождение продуктов реакции и переход фермента в исходное состояние
Слайд 21
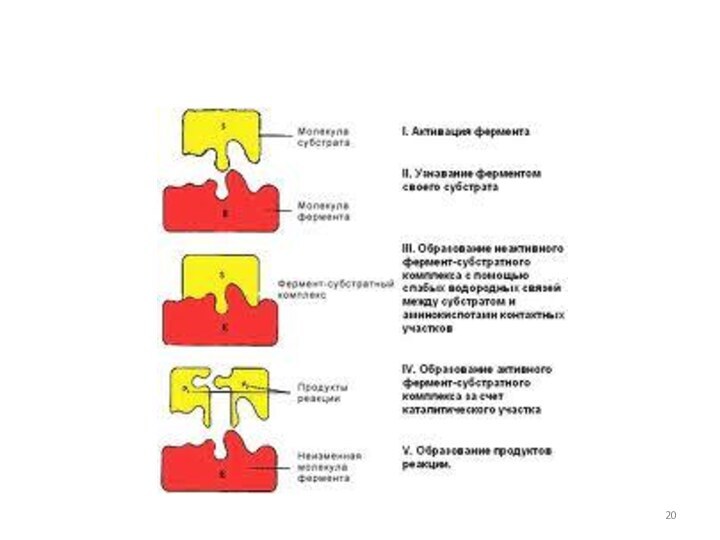
Гипотеза Кошланда об индуцированном соответствии
Слайд 22
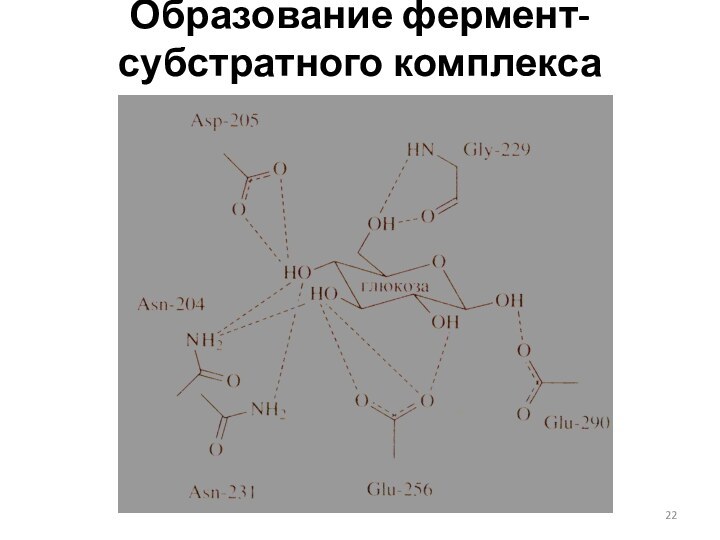
Образование фермент-субстратного комплекса
Слайд 23
Кинетика ферментативных реакций
Это раздел энзимологии, изучающий
зависимость скоростей реакции, катализируемых ферментами, от различных факторов.
Скорость ферментативных реакций (V) измеряют по убыли субстрата (S) или приросту продукта (P) за единицу времени.
Слайд 24
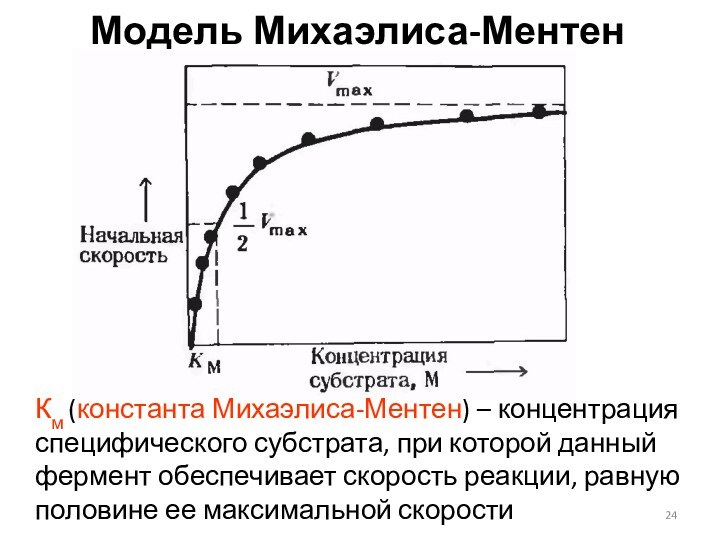
Модель Михаэлиса-Ментен
Км (константа Михаэлиса-Ментен) – концентрация специфического
субстрата, при которой данный фермент обеспечивает скорость реакции, равную
половине ее максимальной скорости
Слайд 25
Уравнение Михаэлиса-Ментен
кv0 начальная скорость при концентрации субстрата
[S], Vmax – максимальная скорость и
Км – константа
Михаэлиса-Ментен для данного фермента, соответствующая определенному субстрату
Слайд 26
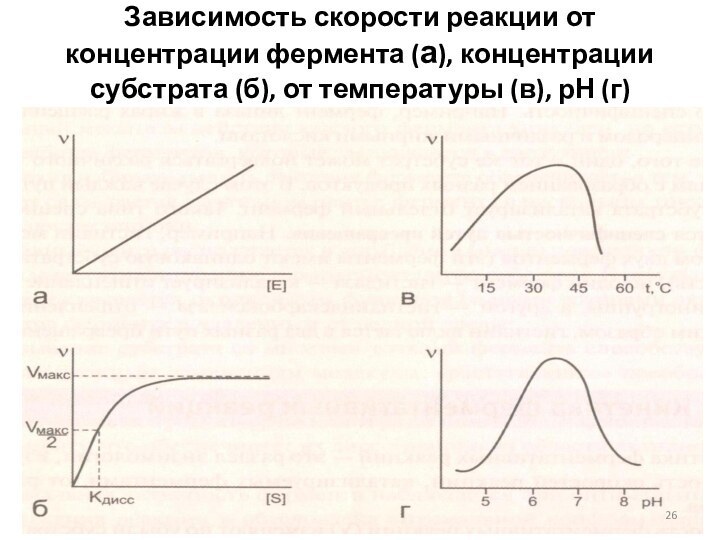
Зависимость скорости реакции от концентрации фермента (а), концентрации
субстрата (б), от температуры (в), рН (г)
Слайд 27
Единица активности и Удельная активность
Фермента
Количество фермента можно определить
по его активности.
За единицу активности фермента принимается такое количество
фермента, которое катализирует превращение 1 мкмоля субстрата (1 мкмоль = 10–6 моля) в 1 мин при 25°С в оптимальных условиях действия фермента.
Удельной активностью называется число единиц ферментативной активности в расчете на 1 мг белка.
Слайд 28
СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
Различают два главных вида специфичности ферментов:
СУБСТРАТНАЯ
СПЕЦИФИЧНОСТЬ
СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ
Слайд 29
Субстратная специфичность - это способность фермента
катализировать превращения только одного определенного субстрата или же группы
сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
Различают 3 типа субстратной специфичности:
Абсолютная субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата.
Относительная субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов.
Стереоспецифичность - способность фермента катализировать превращения определенных стереоизомеров.
Фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду , т.е. обладает относительной субстратной специфичностью и стереоспецифичностью одновременно.
Слайд 30
Специфичность действия - это способность фермента
катализировать только определенный тип химической реакции.
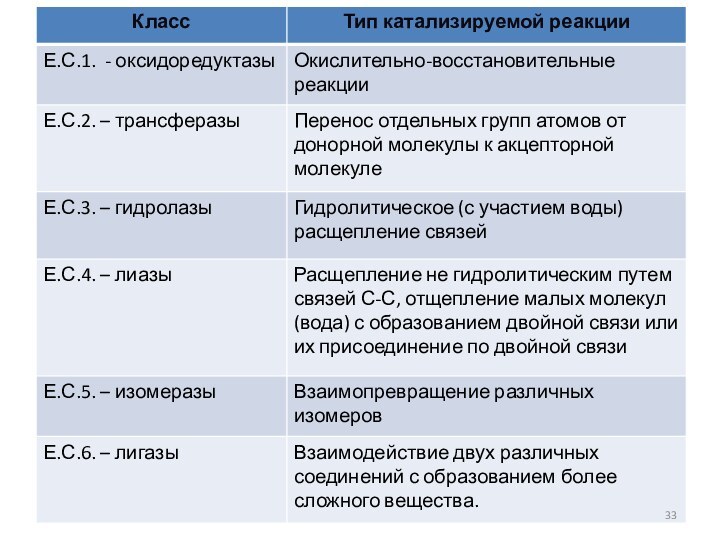
В соответствии со специфичностью действия все ферменты делятся на 6 классов.
Слайд 31
Классификация названий
Рабочие названия образуются из объединения названия
субстрата, типа реакции и окончания "-аза". Например: ЛАКТАТ +
ДЕГИДРОГЕНизация + АЗА =
ЛАКТАТДЕГИДРОГЕНАЗА
Систематическое название фермента формируется следующим образом: (название субстратов (через дробь), название типа химического превращения + аза). Та же лактатдегидрогеназа будет иметь систематическое название
"L-лактат:NAD+ оксидоредуктаза".
Слайд 32
Классификация энзимов –
Е.С. (Enzyme Classification)
Классы ферментов
обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой
цифре. Каждый класс разделен на подклассы и подподклассы, которые уточняют специфичность действия данного фермента.
Слайд 34
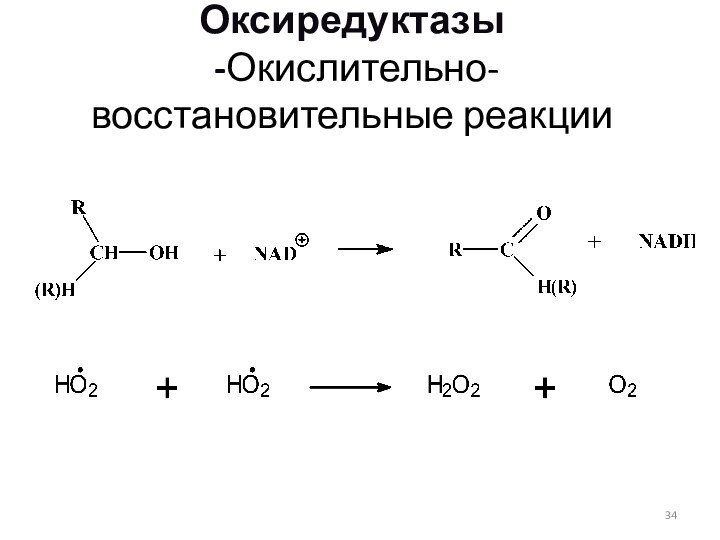
Оксиредуктазы
-Окислительно-восстановительные реакции
Слайд 35
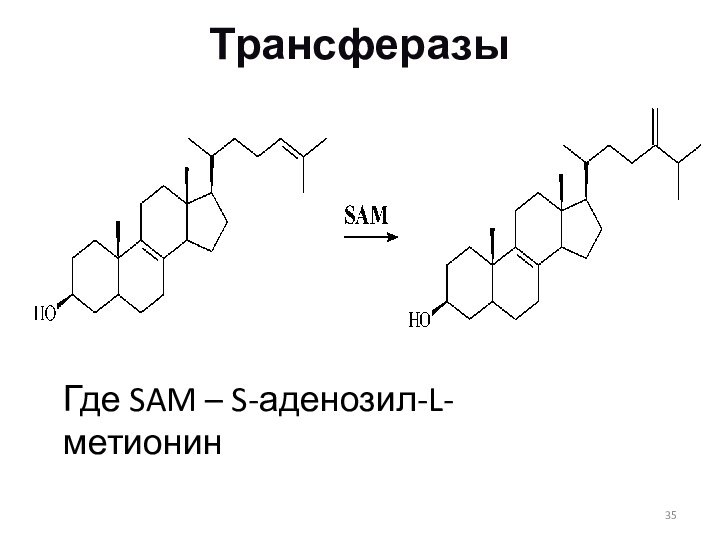
Трансферазы
Где SAM – S-аденозил-L-метионин
Слайд 36
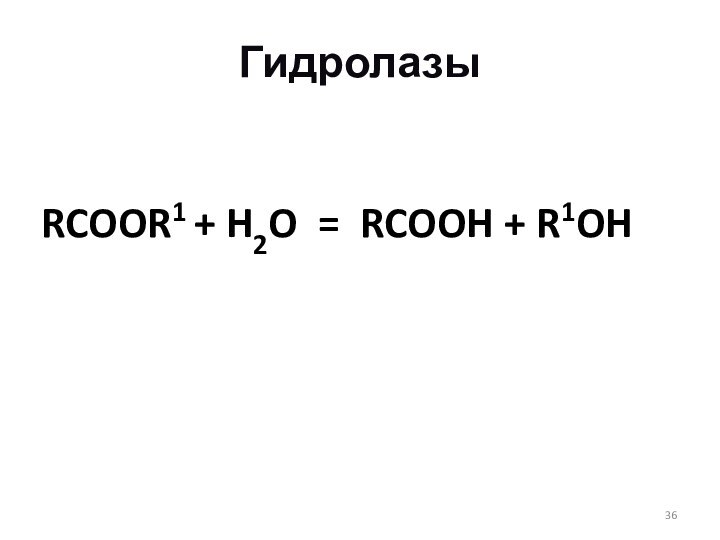
Гидролазы
RCOOR1 + H2O = RCOOH + R1OH
Слайд 40
Ингибиторы ферментов - это вещества, снижающие их активность.
Различают
ингибиторы:
необратимые
обратимые
Необратимые ингибиторы прочно связываются и блокируют функциональные
группы активного центра фермента, необходимые для проявления его активности.
Слайд 41
Обратимые ингибиторы
Конкурентные – конкурируют с субстратом за связывание
с активным центром фермента (ингибитор и субстрат имеют участки
со сходной структурой).
S – субстрат; I – ингибитор
Связывание S и I происходит взаимоисключающим образом. Образуется либо ES, либо EI, но не EIS
Конкурентное ингибирование ГМГ-КоА-редуктазы ловастатином
Слайд 43
2.Неконкурентные ингибиторы – присоединяются к
ферменту не в активном центре, а в другом участке
молекулы. Связывание приводит к изменению конформации фермента и нарушению комплементарности к субстрату.
Слайд 44
Активаторы ферментов
Это вещества, увеличивающие скорость ферментативной реакции.
Чаще всего
в качестве активаторов выступают ионы металлов, такие как
Слайд 45
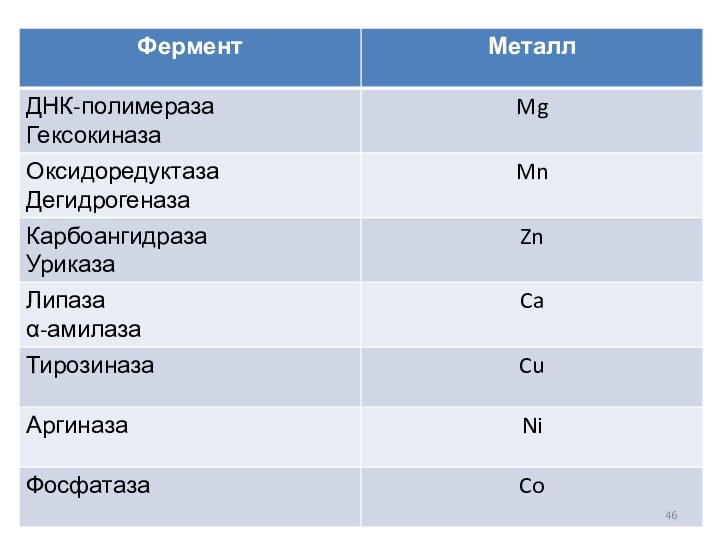
Активаторы ферментов
Это вещества, увеличивающие скорость ферментативной реакции.
Чаще всего
в качестве активаторов выступают ионы металлов, такие как Fe,
Cu, Co, Mg и др.
Металлы-активаторы участвуют в образовании стабильной переходной конформации фермента, что способствует более быстрому образованию фермент субстратного комплекса.
Слайд 47
Регуляция активности ферментов
Аллостерическая регуляция. Фермент может изменять активность
в результате нековалентного взаимодействия с эффекторами.
Слайд 48
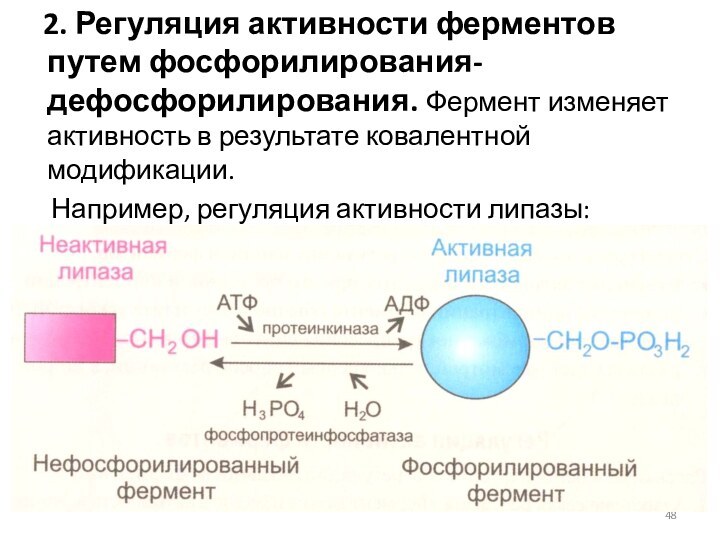
2. Регуляция активности ферментов путем
фосфорилирования-дефосфорилирования. Фермент изменяет активность в результате ковалентной модификации.
Например, регуляция активности липазы:
Слайд 49
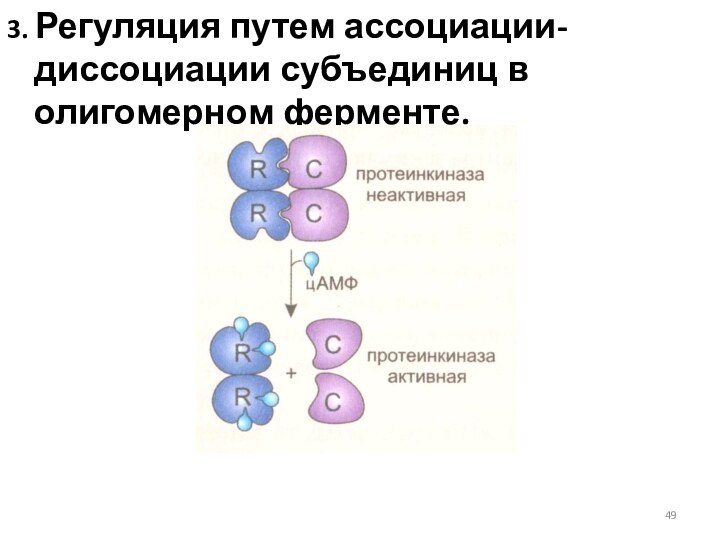
3. Регуляция путем ассоциации-диссоциации субъединиц в олигомерном ферменте.



















![Ферменты и их роль Уравнение Михаэлиса-Ментен кv0 начальная скорость при концентрации субстрата [S], Vmax –](/img/tmb/13/1274479/9dddb158956b330cf9e96e8b5e0bafbc-720x.jpg)