Слайд 2
Аннотация
Тематика презентации рассчитана на учащихся 9х классов

Навыки и знания компьютера не требует от учащихся
Созданная
презентация позволяет учащимся анализировать, оценивать, размышлять, делать выводы, уметь сравнивать, вырабатывать умения самостоятельно работать на уроке.
Созданная презентация позволяет учащимся опираясь на ранее полученные знания, познакомить учащихся со свойствами фосфора, строением, получением, аллотропными модификациями, нахождением в природе, области применения.
Содержание презентации соответствует утвержденному минимуму знаний по предмету и стандартом обучения.
Презентация позволяет каждому ученику почувствовать себя соавтором, соучастником в проведении урока, раскрыть имеющийся потенциал возможностей ученика.
Использование современных технологий помогает учащимся выполнять работу быстрее, качественней, и на более глубоком уровне. Целесообразно использовать новые технологии для получения необходимых знаний, умений и навыков по конкретному предмету школьной программы.
Слайд 3
Цели урока:
Тип урока – Изучение нового материала
Цели урока:
Опираясь на ранее полученные знания учащихся, познакомить учащихся со
свойствами фосфора как простого вещества, его строением, свойствами, получением.
Аллотропные модификации фосфора
Нахождение в природе
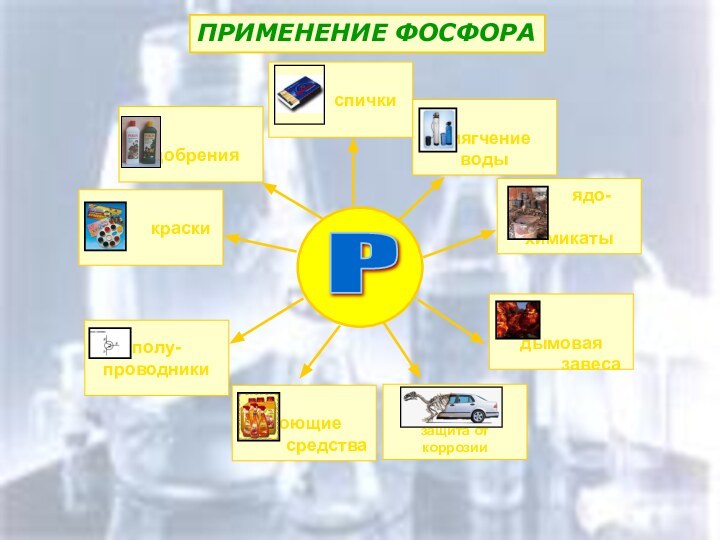
Области применения
Развивать у учащихся умение выделять главное, уметь сравнивать, обобщать и развивать мышление, вырабатывать умения самостоятельно работать на уроке.
Слайд 4
Девиз урока:
«Иногда фосфор может быть дороже любого драгоценного
металла»
Слайд 5
мотивация
Я – светоносный элемент,
Я спичку
вам зажгу в момент,
Сгореть смогу и под
водой,
Оксид в ней станет кислотой.
Это - фосфор
Слайд 7
"визитка химического элемента"
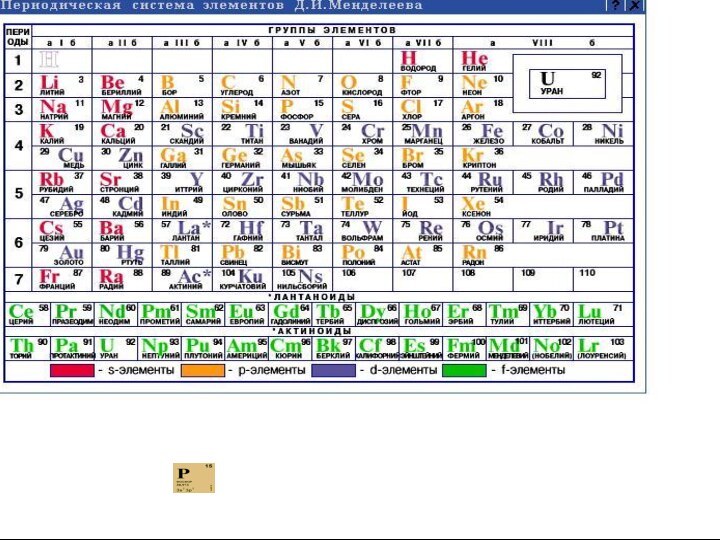
порядковый номер:
15
период:
III
группа:
V
подгруппа:
главная
Слайд 8
Валентные возможности фосфора
P* 3s13p33d1
3p
3s
3d
3p
3s
3d
P 3s23p3
В электронно-возбужденном состоянии
образуется 5ковалентных связей. До завершения р-подуровня не хватает 3х
электронов, поэтому они могут их принимать при взаимодействии с сильными восстановителями, либо при взаимодействии с неметаллами. В соединениях проявляет следующие степени окисления -3, 0, +3, +5.
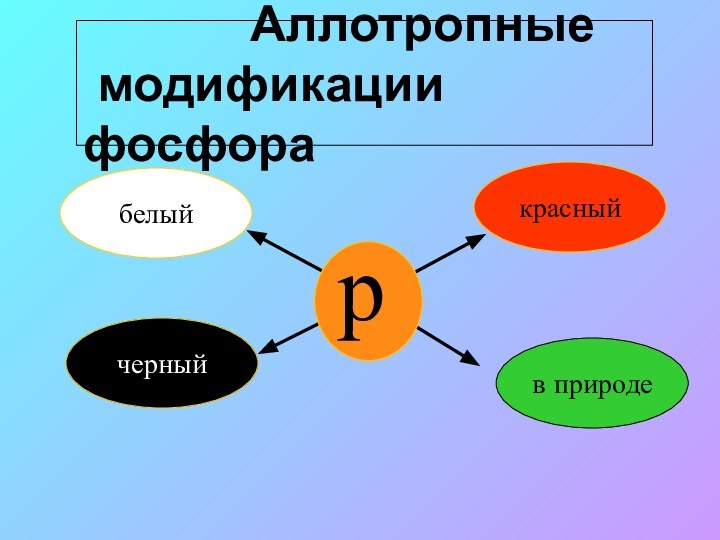
Аллотропные
модификации фосфора
белый
черный
красный
в природе
Слайд 10
Молекула белого фосфора имеет формулу тетраэдра. Это легкоплавкое
Тпл =44,10 С, Ткип=275 оС, мягкое, бесцветное, воскообразное вещество.
Хорошо растворимое в сероуглероде и ряде других органических растворителях. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды.
молекула белого фосфора
Кристаллическая решетка
Черного фосфора.
Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником. Не ядовит.
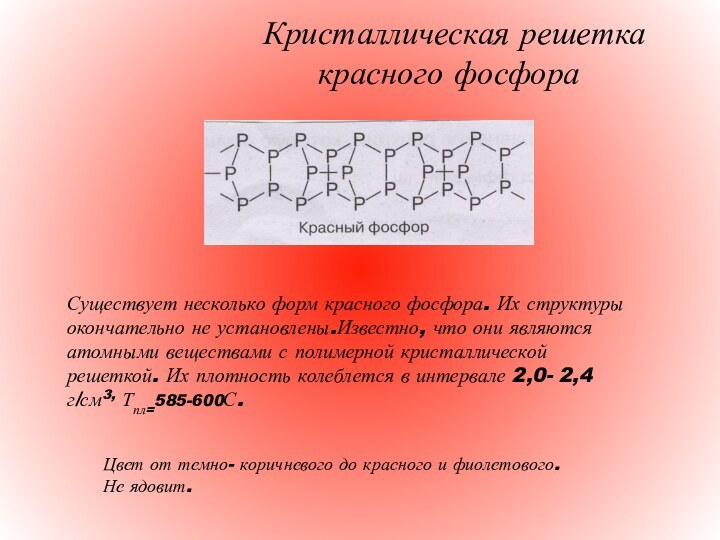
Кристаллическая решетка
красного фосфора
Существует несколько форм красного фосфора. Их структуры окончательно не установлены.Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их плотность колеблется в интервале 2,0- 2,4 г/см3, Тпл=585-600С.
Цвет от темно- коричневого до красного и фиолетового. Не ядовит.
Слайд 13
Фосфор в природе
Фосфор в природе
Фосфор встречается только
в химически связанном виде : в организме и минералах.
В живых организмах фосфор содержится в виде фосфолипидов (МОЗГОВОМ ВЕЩЕСТВЕ), ФОСФОПРОТЕИДОВ(ФЕРМЕНТЫ), РАЗЛИЧНЫХ ЭФИРОВ ОРТОФОСФОРНОЙ КИСЛОТЫ И ОРТОФОСФАТА КАЛЬЦИЯ(В КОСТЯХ, ЗУБАХ).
Слайд 14
Взаимодействие фосфора с кислородом
Взаимодействие фосфора с кислородом
Р4+ 5О2 =Р4О10
самовоспламенение на воздухе
4Р(красный) + 5О2 = Р4О10
выше 4000С
4Р (черный) + 5О2 = Р4О10
загорается с большим трудом
В обычных условиях химическая активность фосфора во многом зависит, в какой аллотропной форме он находится. Самым активным является белый фосфор, за счет малой прочности Р-Р связи в молекуле Р4
Слайд 15
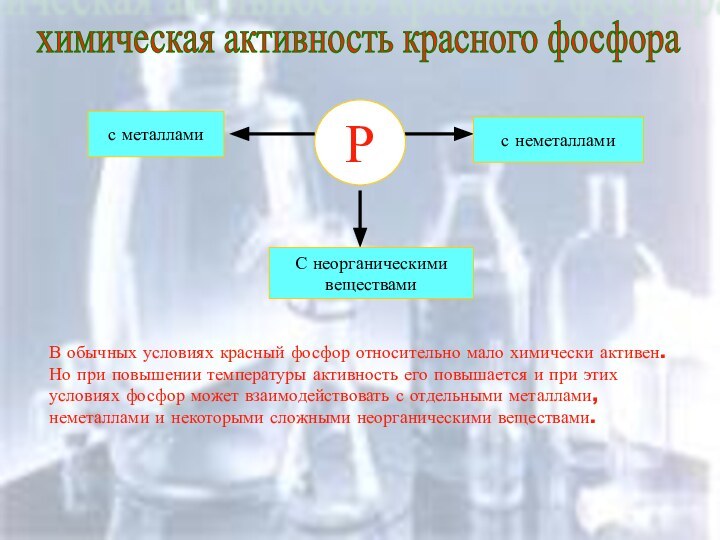
химическая активность красного фосфора
Р
с металлами
С неорганическими
веществами
с неметаллами
В обычных
условиях красный фосфор относительно мало химически активен. Но при
повышении температуры активность его повышается и при этих условиях фосфор может взаимодействовать с отдельными металлами, неметаллами и некоторыми сложными неорганическими веществами.
Слайд 16
взаимодействие фосфора с металлами
Na + P =
Na3P
2000C
Ca
+ P =
Ca3P2
2
2
3
350-4500C
Фосфор относительно легко реагирует со щелочными и
щелочноземельными металлами. Металлические производные называются ФОСФИДАМИ. Эти вещества неустойчивы по отношению к воде и растворам кислот, которые необратимо разлагаются.
Ca3P2 + H2O = Ca(OH)2 + PH3
фосфин
Слайд 17
взаимодействие фосфора с неметаллами
4P + 3O2 = P4O6
(при недостатке кислорода)
P4 + 5O2 = P4O10 (при
избытке кислорода)
2P + 5F2 = 2PF5
2P + 3CI2 = 2PCI3 (30-400C)
Наиболее легко идут реакции с кислородом и галогенами.
Слайд 18
Взаимодействие фосфора с неорганическими соединениями
Взаимодействие фосфора с неорганическими
соединениями
При повышенной температуре фосфор может реагировать с отдельными
неорганическими веществами, прежде всего с сильными окислителями, водой, растворяется в щелочах.
Слайд 19
Промышленный способ получения
Промышленный способ получения
В промышленности фосфор
получают из фосфоритов и апатитов. Метод основан на реакции
восстановления Ca3(PO4)2 коксом до фосфора. Для связывания соединений кальция добавляют кварцевый песок (SIO2). Процесс проводят в электропечах. Продукт реакции- белый фосфор, который затем длительным нагреванием превращают в красный.
Слайд 21
Осуществите превращения
Какие элементы имеют аллотропные модификации?
хлор
азот
фосфор
фтор
Слайд 24
Какие из указанных неметаллов образуют
водородные соединения типа
ЭН3?
фосфор
сера
йод
бром
Слайд 25
Какая химическая ошибка была допущена в произведении?
…. Да!
Это была собака, огромная, черная, как смоль. Но такой
собаки еще никто из нас, смертных, не видывал. Из ее открытой пасти вырывалось пламя, по морде и загривку переливался мерцающий огонь…
Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте.
«Фосфор», - сказал я.
А. Конан Дойл.
«Собака Баскервилей»
Слайд 26
домашнее задание
На основе опорного конспекта составьте рассказ
по данной теме.
Слайд 27
Желаю удачи
с уважением Кононенко С.Ю.