- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему С о е д и н е н и я с е р ы
Содержание
- 2. С О Е Д И Н Е Н И ЯС Е Р Ы
- 3. степень окисления серы -2Сероводород - Н2SСульфиды
- 4. Н2SСЕРОВОДОРОДЭто - ядовитый газ со специфическим запахом,
- 5. Получение: водород + сера
- 6. Сульфиды металлов - соли от сероводородной кислотыСульфидыобразованы
- 7. степень окисления серы + 4Сернистый газ –SO2 Сернистая кислота –H2SO3Сульфиты – K2SO3, BaSO3
- 8. СЕРНИСТЫЙ ГАЗSO2Оксид серы(lV) – сернистый газ, являющийся
- 9. Получение: разложение сернистой кислотыH2SO3 -----SO2 +
- 10. Химические свойства: с водойSO2 + H2O---H2SO3
- 11. Составьте уравнения реакций оксида серы (Vl) с
- 12. Сернистая кислота – очень слабая, неустойчивая, легко
- 13. степень окисления серы + 6Серный ангидрид
- 14. Оксид серы (Vl) – кислотный оксид, получается
- 15. Н2SO4Два вида солей от серной кислоты:средние –
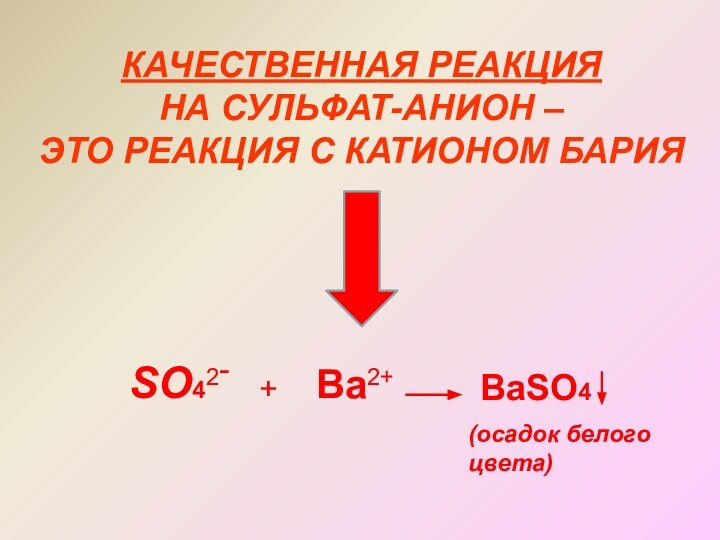
- 16. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СУЛЬФАТ-АНИОН –ЭТО РЕАКЦИЯ С КАТИОНОМ БАРИЯSO42-+Ba2+BaSO4(осадок белогоцвета)
- 17. Н2SO4Серная кислота - тяжелая бесцветная жидкость, которая
- 18. Взаимодействие разбавленной иконцентрированной кислоты с металлами разнойактивности
- 19. Н2SO4 + Ме (до Н2)
- 20. Выполните заданиепо вариантам:1 вариант – сернистый газ2
- 21. Это простое веществоЭто соединение с высшей
- 22. Сульфат меди(ll)Сульфат алюминияСульфат барияСульфат хрома(lll)Сульфат железа(ll)Сульфат кобальтаНайдите соответствие междуназванием соли и ееизображением
- 23. Самостоятельная работа по вариантам:
- 24. 1 вариант2 вариантСоставить о.в.р:Серная кислота разб. +
- 25. Скачать презентацию
- 26. Похожие презентации
























Слайд 3
степень
окисления
серы -2
Сероводород - Н2S
Сульфиды неметаллов
– CS2,
P2S3Сульфиды металлов – Al2S3,
K2S
Слайд 4
Н2S
СЕРОВОДОРОД
Это - ядовитый газ со специфическим запахом,
тяжелее
воздуха и кислорода, растворимый в воде.
При его растворении
получается сероводородная кислота, являющаяся очень слабой, т.е. практически неэлектролитомЧеловек, попавший в атмосферу почти чистого сероводорода, внезапно, без всяких предварительных симптомов, теряет сознание и падает мертвым. Если вдыхать его даже в небольших количествах, и тогда смерть наступает быстро
Слайд 5
Получение: водород + сера
H2
+ S ----H2Sсульфид металла + сильная кислота
ZnS + 2HCL---ZnCl2 + H2S
конц. серная кислота + активный металл
8Na + 5H2SO4 -----4Na2SO4 + H2S + 4H2O
Химические свойства: сгорание
2H2S + 3O2----2SO2 + 2H2O
взаимодействие с некоторыми солями тяжелых металлов
H2S + CuCl2---CuS + 2HCl
взаимодействие с некоторыми неорганическими веществами по реакциям окисления-восстановления
2H2S + SO2---3S + 2H2О
Слайд 6
Сульфиды металлов -
соли от сероводородной кислоты
Сульфиды
образованы очень
слабой кислотой,
поэтому все подвергаются
гидролизу
Растворимые из них только
солищелочных и
щелочно-земельных
металлов
Слайд 7
степень
окисления
серы + 4
Сернистый газ –SO2
Сернистая кислота –H2SO3
Сульфиты – K2SO3, BaSO3
Слайд 8
СЕРНИСТЫЙ ГАЗ
SO2
Оксид серы(lV) – сернистый газ, являющийся одним
из главных загрязнителей атмосферного воздуха,
кислотный оксид, очень хорошо
растворимый в воде, образует слабую сернистую кислоту
Слайд 9
Получение:
разложение сернистой кислоты
H2SO3 -----SO2 + H2O
сгорание
серы
S + O2 ---SO2
обжиг сульфидов металлов
2ZnS + 3O2 ---2SO2
+ 2H2Oдействие на сульфиты сильных кислот
BaSO3 + 2HCl---BaCl2 + SO2 + H2O
конц. серная кислота + неактивные металлы
Cu + 2H2SO4 ---CuSO4 + SO2 + 2H2O
Слайд 10
Химические свойства:
с водой
SO2 + H2O---H2SO3
с основными оксидами
SO2 + BaO---BaSO3
с щелочами
SO2 + 2KOH---K2SO3 + H2O
с амфотерными оксидами и гидроксидами
SO2 + ZnO---ZnSO3
3SO2 + 2AL(OH)3---AL2(SO3)3 + 3H2O
Слайд 11 Составьте уравнения реакций оксида серы (Vl) с водой,
оксидом натрия, гидроксидом кальция, оксидом алюминия.
Назовите продукты реакции.
Выполните задание:
Проверьте
себя:SO2 + H2O---H2SO3
SO2 + Na2O---Na2SO3
SO2 + Ca(OH)2---CaSO3 + H2O
3SO2 + Al2O3---Al2(SO3)3
Слайд 12
Сернистая кислота – очень слабая,
неустойчивая, легко разлагается
на сернистый газ и воду (является аналогом
угольной кислоты).
Соли
ее – сульфиты, растворимые из нихтолько соли щелочных металлов.
Сульфиты - это средние соли (CaSO3),
но есть и кислые – гидросульфиты (NaHSO3).
Сульфиты и гидросульфиты реагируют
с сильными кислотами с образованием
сернистого газа
K2SO3 + 2HNO3---2KNO3 + SO2 + H2O
Слайд 13
степень
окисления
серы + 6
Серный ангидрид
или
оксид серы (Vl) –SO3
Серная кислота –H2SO4
Сульфаты – K2SO4,
СaSO4
Слайд 14
Оксид серы (Vl) – кислотный оксид,
получается при
окислении сернистого газа
2SO2 + O2---2SO3
Химические свойства подобные,
как у сернистого
газаПри реакции с водой –
SO3 + H2O---H2SO4
данный оксид дает сильную, двухосновную,
кислородосодержащую кислоту,
которая является
высшим гидроксидом серы
Слайд 15
Н2SO4
Два вида солей от
серной кислоты:
средние – сульфаты
CaSO4
и
кислые – гидросульфаты
Ba(HSO4)2
Сульфаты металлов средней
активности и неактивных
металловподвергаются гидролизу
по катиону металла
Слайд 16
КАЧЕСТВЕННАЯ РЕАКЦИЯ
НА СУЛЬФАТ-АНИОН –
ЭТО РЕАКЦИЯ С КАТИОНОМ
БАРИЯ
SO42-
+
Ba2+
BaSO4
(осадок белого
цвета)
Слайд 17
Н2SO4
Серная кислота - тяжелая бесцветная жидкость, которая бывает
концентрированная
и разбавленная, в зависимости
от этого по-разному реагирует с
металлами, а концентр. может реагировать и с неметалламиСлайд 19 Н2SO4 + Ме (до Н2)
сульфат + водород
Н2SO4
( концентр.)
+ металл (до
Н2) сульфат + сероводород
(или сера) + вода
+ металл (после Н2)
сульфат + сернистый газ
+ вода
(разбавл.)
Слайд 20
Выполните задание
по вариантам:
1 вариант – сернистый газ
2 вариант
– серная кислота
Вам даны 15 утверждений.
Определите, какие из
них истинные, а какие ложные
Слайд 21
Это простое вещество
Это соединение с высшей
степенью окисления серы
3. Это сильный электролит
4. Это вещество в
газообразном агрегатном состоянии
5. В нем ковалентная полярная связь
6. В нем молекулярная кристаллическая решетка
7. Оно легко реагирует с кислотами
8. Оно окислитель за счет серы
9. Оно реагирует с цинком
10. Оно хорошо растворяется в воде
11. Оно диэлектрик
12. Оно может окисляться
13. Оно реагирует с щелочами
14. Оно вступает в окислительно-
восстановительные реакции
15. Из него можно получить кислоту
Слайд 22
Сульфат меди(ll)
Сульфат алюминия
Сульфат бария
Сульфат хрома(lll)
Сульфат железа(ll)
Сульфат кобальта
Найдите соответствие
между
названием соли и ее
изображением
Слайд 24
1 вариант
2 вариант
Составить о.в.р:
Серная кислота разб. +
натрий
2. Серная кислота разб. +
медь
3. Серная кислота конц. +
калий
4. Серная кислота конц. +
медь
5. Сульфат меди(2) + цинк
Серная кислота разб +
магний
2. Серная кислота разб. +
калий
3. Серная кислота конц. +
серебро
4. Серная кислота конц. +
магний
5. Сульфат железа(2) +
литий
Составить в ионном виде:
Сульфит натрия +
хлорная кислота
Сульфид железа(2) +
азотная кислота
Сульфат натрия +
хлорид бария
Серная кислота +
алюминий