- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Комплексті қосылыстар
Содержание
- 2. Жоспар:1.Комплексті қосылыстардың құрылысы. Вернердің координациялық теориясының негізгі
- 3. КҚ құрылысы Химиялық қосылыстар
- 4. КҚ химиялық байланыстың табиғаты Қазіргі кезде комплексті
- 5. Кобальт катионының валенттік қауызында төрт бос
- 7. Kомплексті қосылыстар туралы ілімнің негізін жасаған швейцарияғалымы
- 8. Комплекс түзуші ион немесе атом бұл ішкі
- 9. Комплексті қосылыстың құрамы белгілі болса, комплекс түзушінің
- 10. КҚ ЖІКТЕЛУІI. Комплекстер ішкі
- 11. II. Лигандтың табиғаты бойынша КҚ бөледі: Аммиакаттар
- 12. III.Ішкі сферасының құрылысы бойынша Комплекс түзуші иондар
- 13. IV.Геометриялық пішініне қарай Координациялық саны 2 комплекстерде
- 14. Координациялық саны 4 болғанда комплексті ионның құрылысы тэтраэдр немесе квадратты болып келеді.
- 15. Координациялық саны 5 болып келетін
- 16. КҚ номенклатурасы 1962 жылы химиктердің Халықаралық
- 17. Катионды комплексті атағанда ішкі сферадан басталады:Орталық атом
- 18. Анионды комплекстің аталуы:Сыртқы сферадағы ионды
- 19. КҚ изомериясы Изомерлер- құрамдары бірдей,
- 20. Координациялық изомерия – екі түрлі лигандтардың екі
- 21. Геометриялық изомерия – комплекс құрамында кем дегенде
- 22. Комплексті қосылыстардың маңызы Халық шаруашылығында қолданады: оларды
- 23. Комплексті қосылыстар жануарлар мен өсімдіктердің тіршілік процестерінде
- 24. Комплекс түзуші элементтерді “тіршілікті
- 25. Дәрілік заттар[Pt(NH3 )2Cl2 ]Na ₃[Au(S2O3)2 ]
- 26. Скачать презентацию
- 27. Похожие презентации
Жоспар:1.Комплексті қосылыстардың құрылысы. Вернердің координациялық теориясының негізгі қағидалары2.КҚ химиялық байланыстың табиғаты3.КҚ жіктелуі4.КҚ номенклатурасы5.КҚ тұрақтылығы6.КҚ изомериясы7.КҚ медицинада және фармацияда қолданылуы




















![Комплексті қосылыстар Дәрілік заттар[Pt(NH3 )2Cl2 ]Na ₃[Au(S2O3)2 ]](/img/tmb/15/1436885/b158249a7c379a11aea1c905d4eb8f79-720x.jpg)

Слайд 2
Жоспар:
1.Комплексті қосылыстардың құрылысы. Вернердің координациялық теориясының негізгі қағидалары
2.КҚ
химиялық байланыстың табиғаты
фармацияда қолданылуы
Слайд 3
КҚ құрылысы
Химиялық қосылыстар барлығы қарапайым
немесе атомдық қосылыстар және комплексті немесе молекулалық қосылыстар деп
екіге бөлінеді. Атомдық қосылыстарға жатады: оксидтер, негіздер, қышқылдар, жәй тұздар(иондық немесе атомдық байланысы бар)Бұларды I-ші реттік қоспалар деп атайды.
II-ші реттік қоспаларға жататын күрделі коспалар (молекулалардан немесе иондардан құралады). Олардың арасында координациялық немесе донорлы-акцепторлы байланысы болады.
Сондықтан: КҚ дегеніміз - бұл кристалды тордың түйіндерінде орналасатын күрделі бөлшектер (комплексті иондар), балқыған немесе еріген жағдайына ауысқан кезде өздерінің қалпын сақтайтын қосылыстар және құрамында бір донорлы-акцепторлы байланысы бар заттар.
Мысалы:
K[ Ag(CN)2] ↔ K⁺ + [Ag(CN)2]⁻
Слайд 4 КҚ химиялық байланыстың табиғаты Қазіргі кезде комплексті қосылыстарда байланыстың
табиғатын қарастыратын үш теориялық әдісі бар:
Валенттік байланыс әдісі
Кристалдық
өріс теориясыМолекулалық орбитальдар әдісі
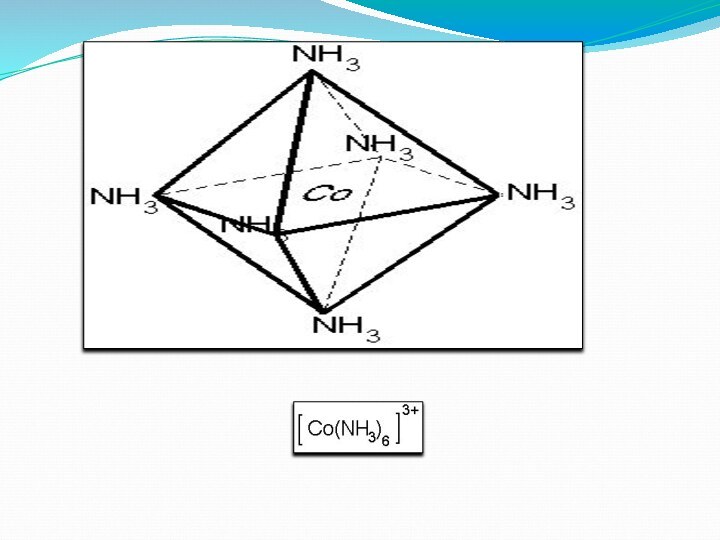
Валенттік байланыс әдісі (ВБӘ) бойынша орталық атом мен лиганд донорлы-акцепторлы жол мен байланысады. Орталық атом байланыс түзуге бос орбитальдарын, ал лиганд пайдаланылмаған электрон жұбын жұмсайды. Мысалы: : [ Co(NH3)6 ] 3+
Co
59
27
1s²2s²2p⁶3s²3p⁶3d⁷4s²
3d⁷
4s²
4p°
Слайд 5 Кобальт катионының валенттік қауызында төрт бос орбиталі
бар.
Кобальт катионының қоздыру арқылы деңгейшесіндегі жалқы электрондарды
өзара жұптастырып, бос орбитальдар санын алтыға дейін жоғарылатуға болады. Қозған күйіндегі кобальт катионының алты бос орбиталдары бар.
Аталған бос орбитальдар байланыс түзуге қатыспастан бұрын гибридті орбитальдарға айналады. Кобальт катионының аталған орбиталі молекуласының құрамындағы азот атомының екі электронды орбиталімен жұптасқанда комплексті катион түзіледі.
Кобальт катионының гибридті орбитальдары октаэдр төбесіне бағытталған. Түзілген комплекстің құрылысы октаэдр болады.
Слайд 7
Kомплексті қосылыстар туралы ілімнің негізін жасаған швейцария
ғалымы Альфред
Вернер (1893ж)
Вернер жұмысы координациялық теория деп аталады.
Координациялық теорияның
негізгі қағидалары:КҚ орталық орын алып тұрған ион немесе атом комплекс түзуші деп аталады.
Комплекс түзушінің айналасына соның әсері жететіндей жақындықта координацияланған иондарды немесе молекулаларды лигандалар (аддентер) деп атайды.
Комплекс түзуші мен лигандалар бірігіп, комплексті қосылыстың ішкі сферасын құрайды.
Ішкі сфераны квадрат жақшаға алады: [ PtCl6 ]2-
Ішкі сфераға орналаспай қалған иондар комплекс түзушіден алысырақ орналасады, олар комплексті қосылыстың сыртқы сферасын құрайды.
Комплекс түзушінің айналасына координацияланған лигандтардың жалпы саны сол комплекс түзушінің координациялық саны деп аталады.
Жиі кездесетін комплексті қосылыстарда координациялық сан алтыға немесе төртке тең, сирек екіге, не үшке тең болады.
Слайд 8 Комплекс түзуші ион немесе атом бұл ішкі сферасының
орталық атомы(ионы). Көбінесе р-, d-, f- элементтер жатады (бос
орбитальдары бар элементтер – Cu, Au, Ag, Hg, Zn, Fe, Co, Cr т.б.)Лигандалар –бұл молекулалар немесе иондар КТ айналасында орналасқан.Көбінесе мыналар жатады
Hal-галоген NO3- -нитрат NO2 -нитрит SO4 -сульфат SO3 -сульфит CO3 -карбонат CN-циан
H2O–аква NH3-аммин CO-карбонил NO-нитроза OH-гидроксо
O-окси SCN-родано
Бұл қосылыстарда пайдаланбаған электрон жұбтары бар
Комплексті ион немесе КҚ ішкі сферасы – бұл КТ және Л тұрады.
Олар донорлы-акцепторлы байланысқан күрделі ион:
[ Аg(CN)2]-
Комплекс ионның заряд саны сыртқы иондар зарядының қосындысына тең, бірақ кері мәнді болады.
Слайд 9 Комплексті қосылыстың құрамы белгілі болса, комплекс түзушінің зарядын
табу қиын емес. Ол үшін комплексті қосылыстың формуласына кіретін
басқа иондардың барлығының зарядтарының алгебралық қосындысын шығарып оған теріс мән қояды.Х = +1
Координациялық көлем немесе денттатылы - лиганданың КТ маңында орналасқан жерінің көлемі.
Лигандтар дентаттылығы бойынша классификацияланады:
бір дентаттылығы (1орын)- H2O, NH3, CO, NO, OH, CN, SCN, Hal
бидентаттылығы (2орын) – CO3, SO4, O, C2O4, H2N-CH2-CH2-NH2
көп дендантты –үш, төрт, бес, алты.
Комплексондар - органикалық лигандтар, өзінің құрамында алкилкарбокситобы амино тобымен байланысқан
Мысалы: (NH2СН2СООН) – α- амин қышқылы
Слайд 10
КҚ ЖІКТЕЛУІ
I. Комплекстер ішкі сферасының
зарядына қарай катионды, анионды және бейтарап болып үш
топқа бөлінеді.Катионды комплекстер орталық ионның айналасына бейтарап молекулалар (NO, NH3, H2O) координацияланғанда түзіледі.
[Al(H ₂O)₆]Cl₃ [Al(H ₂O)₆] ³⁺ +3Clˉ
Комплексті иондар оң зарядталған.
Анионды комплекстерде комплекс түзушінің ролін оң зарядталған ион, ал лигандтар ролін аниондар атқарады.
К[ Аg(CN)2] [ Аg(CN)2]- + К+
Бейтарап комплекстер атомының айналасында молекулалар координацияланғанда немесе оң зарядталған комплекс түзушінің айналасында анион мен молекулалар қатар координацияланғанда түзіледі [ Fe ( CO)5 ]
Слайд 11
II. Лигандтың табиғаты бойынша КҚ бөледі:
Аммиакаттар -
КҚ ішікі сферасында лиганд ретінде NH3 молекуласы бар.
Аквакомплекстер -
КҚ лигандттар су молекулалары болады. Гидроксокомплекстер – лигандалары ОН-
тобы
Ацидокомплекстері - лигандалары қышқыл қалдығы.
Аралас комплекстер - лигандалары аралас.
Слайд 12
III.Ішкі сферасының құрылысы бойынша
Комплекс түзуші иондар санына
қарай бір ядролы және көп ядролы комплекстер
Жай және циклі
бар комплекс, сақиналары бар комплекс.Егер бір лиганда бір координациялы орын алса, оны жәй комплекстер дейді.Циклді немесе хелатты комплексті лигандтар полидентантты(хелаттарға комплексондар жатады СН2-NH2 H2N –CH2
Cu
СН2-NH2 H2N-CH2
Слайд 13
IV.Геометриялық пішініне қарай
Координациялық саны 2 комплекстерде орталық
атом мен екі лиганда бір түзудің бойында орналасады. Құрылысы
түзу сызықты боладыКоординациялық саны 3 сирек комплекс кездеседі.
Бұл комплекс тең қабырғалы үшбұрыш сияқты
Слайд 14 Координациялық саны 4 болғанда комплексті ионның құрылысы тэтраэдр
немесе квадратты болып келеді.
Слайд 15
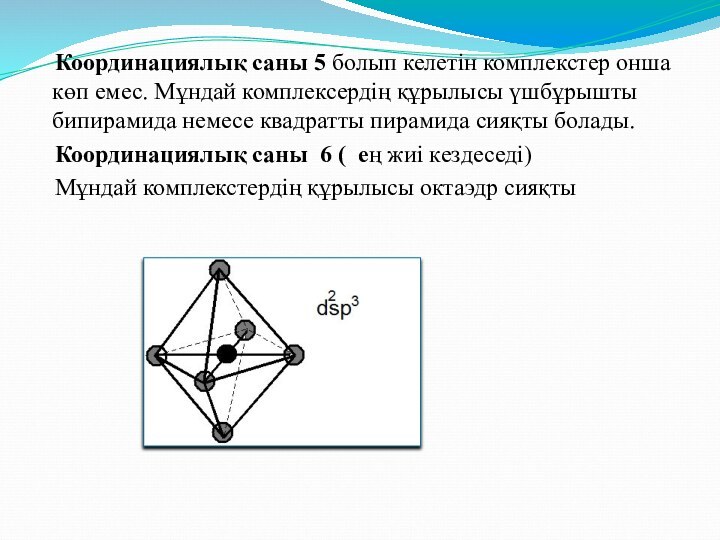
Координациялық саны 5 болып келетін комплекстер
онша көп емес. Мұндай комплексердің құрылысы үшбұрышты бипирамида немесе
квадратты пирамида сияқты болады.Координациялық саны 6 ( ең жиі кездеседі)
Мұндай комплекстердің құрылысы октаэдр сияқты
Слайд 16
КҚ номенклатурасы
1962 жылы химиктердің Халықаралық Одағы
(ІUPAC) ұсынған номенклатурасы қолданылады.
Теріс зарядты лигандтардың атауына «О» деген
жалғау жалғанады СI- хлоро-, СN- циано-. Электробейтарап лигандтар былай аталады:
H2O–аква NH3-аммин CO-карбонил NO-нитрозил
OH-гидроксо O-окси т.б.
Комплекс құрамындағы лигандтардың саны грек сан есімдерімен белгіленеді:
ди (екі), три (үш), тетра(төрт), пента (бес), гекса (алты) т.б.
Слайд 17
Катионды комплексті атағанда ішкі сферадан басталады:
Орталық атом немесе
заряды көрсетіліп КТ ионы.
Саны көрсетіліп теріс зарядталған лигандттар
Саны көрсетіліп
бейтарап лигандттар Сыртқы анионды атайды
Слайд 18
Анионды комплекстің аталуы:
Сыртқы сферадағы ионды айтады
Саны
көрсетіліп теріс зарядталған лигандтар
Саны көрсетіліп бейтарап лигандтар
Комплекс түзуші атомына
- ат деген жалғау жалғанады ( латынша )Бейтарап комплексті атау үшін:
Саны көрсетіліп теріс зарядталған лигандтар
Саны көрсетіліп бейтарап лигандтар
Комплекс түзуші атомы аталады
Слайд 19
КҚ изомериясы
Изомерлер- құрамдары бірдей, бірақ
құрылысы мен қасиеттері әртүрлі заттар. Изомерия құбылысы комплексті қосылыстарда
өте кең таралғанГидраттық немесе сольватты изомерия су молекуласының комплекс құрамында әртүрлі орналасуынан болады.
[Сr(Н2О)6]Сl3, [Сr(Н2O)5Сl]Сl 2*Н2O, [Сr(Н2O)4Сl2]Сl *2Н2O
күлгін түсті күлгін-жасыл жасыл
Иондық изомерия аниондардың ішкі сфера мен сыртқы сфераға әртүрлі таралуынан болады.
[Pt(NH3)3Br]NO2 және [Pt(NH3)3(NO2)]Вr
Слайд 20 Координациялық изомерия – екі түрлі лигандтардың екі комплекс
түзушінің айналасына әртүрлі жолмен координациялануынан болады.
[Co(NH3)6][Cr(C2O4)3]
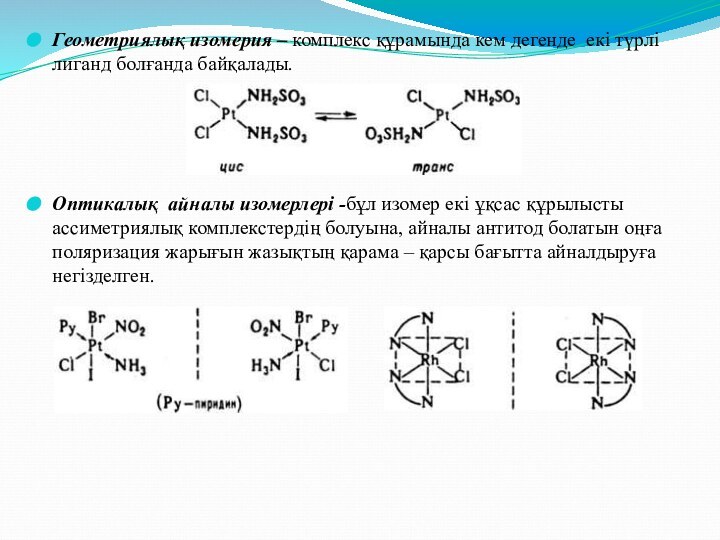
и [Cr(NH3)6][Co(C2O4)3 ]Слайд 21 Геометриялық изомерия – комплекс құрамында кем дегенде екі
түрлі лиганд болғанда байқалады.
Оптикалық айналы изомерлері -бұл изомер екі
ұқсас құрылысты ассиметриялық комплекстердің болуына, айналы антитод болатын оңға поляризация жарығын жазықтың қарама – қарсы бағытта айналдыруға негізделген.
Слайд 22
Комплексті қосылыстардың маңызы
Халық шаруашылығында қолданады: оларды Pt
металдарын, Au, Ag, Cu, Ni, Co алуға және тазалауға
пайдаланылады.Сирек кездесетін металдарды бөлуге аналитикалық химияда сапалық, сандық анализдерге қолданады.Металдарды коррозиядан қорғауға қолданады. Металдарға жабысқақ қасиеті бар тұрақты және ерімейтін комплексті қосылыстар коррозия процесін баяулатады немесе мүлдем тоқтатады.
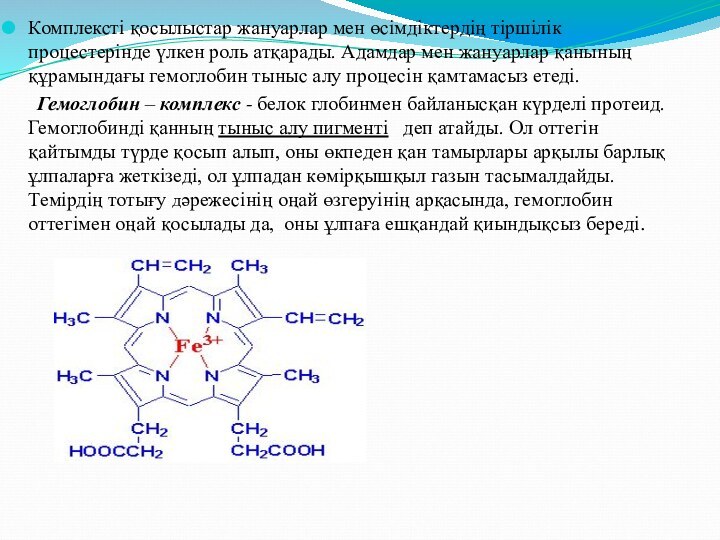
Слайд 23 Комплексті қосылыстар жануарлар мен өсімдіктердің тіршілік процестерінде үлкен
роль атқарады. Адамдар мен жануарлар қанының құрамындағы гемоглобин тыныс
алу процесін қамтамасыз етеді.Гемоглобин – комплекс - белок глобинмен байланысқан күрделі протеид. Гемоглобинді қанның тыныс алу пигменті деп атайды. Ол оттегін қайтымды түрде қосып алып, оны өкпеден қан тамырлары арқылы барлық ұлпаларға жеткізеді, ол ұлпадан көмірқышқыл газын тасымалдайды. Темірдің тотығу дәрежесінің оңай өзгеруінің арқасында, гемоглобин оттегімен оңай қосылады да, оны ұлпаға ешқандай қиындықсыз береді.
Слайд 24 Комплекс түзуші элементтерді “тіршілікті ұйымдастырушылар”
деп атайды. Соңғы кезде Pt-ң және Pd-дың комплексті қосылыстарын
қатерлі ауруларды емдеуге пайдалануға болады.Хелатты комплексті қосылыстарды бүйректегі тастарды ерітуге және судың кермектігін жоюға қолданылады. Комплексті қосылыстарды клиникаларда дәрі-дәрмек ретінде қолданып, әр түрлі ауруларды емдеуді хелатты терапия деп атайды.
Трилон Б көптеген металл иондарымен комплексті қосылыстар түзеді. Сондықтан ағзада кальций тұздары бөліне жүретін ауруларды емдеуге пайдаланылады.
НООС-СН2 CH2COOH
N-CH2-CH2-N немесе Na2H2Tr
NaООС-СН2 CH2COONa
Слайд 25
Дәрілік заттар
[Pt(NH3 )2Cl2 ]
Na ₃[Au(S2O3)2 ]
Қабынуға қарсы
Мыс (II) салицилаты
Ісікке қарсы