Слайд 2
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Основные положения:
Ионы находятся в более устойчивых электронных
состояниях, чем атомы. Они могут состоять из одного атома
- это простые ионы (Na+, Mg2+, Аl3+ и т.д.) - или из нескольких атомов - это сложные ионы (NО3-, SO42-, РО4З- и т.д.).
2. Под действием электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду. Поэтому первые называются катионами, вторые - анионами. Направленное движение ионов происходит в результате притяжения их противоположно заряженными электродами.
3. Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Слайд 3
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Прибор для определения электрической проводимости растворов
Слайд 4
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Электролиты - проводники второго рода. В растворе
или расплаве они распадаются на ионы, благодаря чему и
протекает ток. Очевидно, чем больше ионов в растворе, тем лучше он проводит электрический ток. Чистая вода электрический ток проводит очень плохо.
Вещества, которые в тех же условиях на ионы не распадаются и электрический ток не проводят, называются неэлектролитами.
К электролитам относятся кислоты, основания и почти все соли, к неэлектролитам - большинство органических соединений, а также вещества, в молекулах которых имеются только ковалентные неполярные или малополярные связи.
Распад электролитов на ионы при растворении их в воде называется элекролитической диссоциацией.
Слайд 5
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
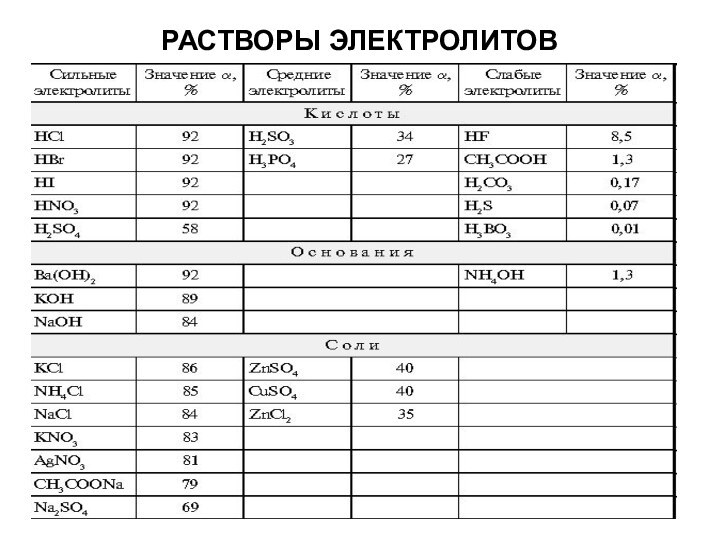
Сильные электролиты при растворении в воде полностью
диссоциируют на ионы:
1)
почти все соли;
2) многие минеральные кислоты, например Н2SO4, HNO3, НСl, HBr, HI, НМnО4, НСlО3, НСlО4;
3) основания щелочных и щелочноземельных металлов.
Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы:
1) почти все органические кислоты;
2) некоторые минеральные кислоты, например H2СО3, Н2S, НNO2, HClO, H2SiO3;
3) многие основания металлов (кроме оснований щелочных и щелочноземельных металлов), а также NH4OH, который можно изображать как гидрат аммиака NH3∙H2O.
4) вода.
Слабые электролиты не могут дать большой концентрации ионов в растворе.
Слайд 6
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Для количественной оценки процесса электролитической диссоциации используется
понятие степени электролитической диссоциации.
Степень электролитической диссоциации - это
отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул:
Степень электролитической диссоциации зависит: от природы растворителя, природы растворяемого вещества, температуры и концентрации раствора
Слайд 8
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Механизм электролитической диссоциации
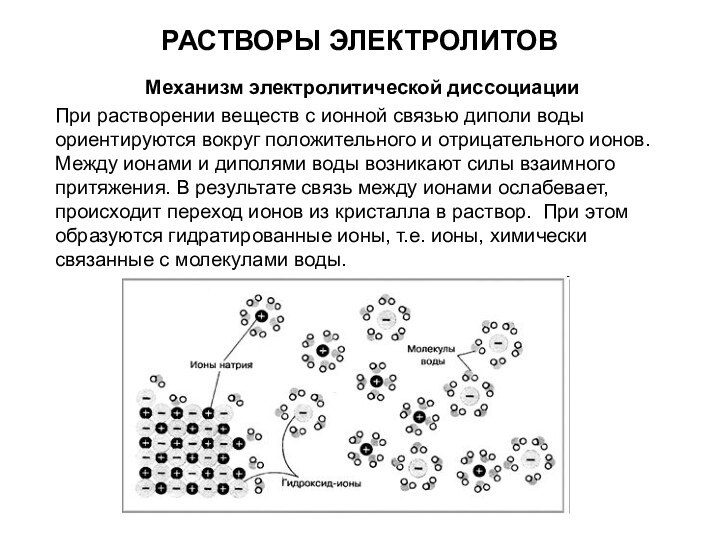
При растворении веществ с ионной
связью диполи воды ориентируются вокруг положительного и отрицательного ионов.
Между ионами и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, происходит переход ионов из кристалла в раствор. При этом образуются гидратированные ионы, т.е. ионы, химически связанные с молекулами воды.
Слайд 9
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Аналогично диссоциируют и электролиты, молекулы которых образованы
по типу полярной ковалентной связи (полярные молекулы).
Вокруг каждой
полярной молекулы вещества ориентируются диполи воды. В результате этого взаимодействия связующее электронное облако (электронная пара) полностью смещается к атому с большей электроотрицательностью, полярная молекула превращается в ионную и затем легко образуются гидратированные ионы . Диссоциация полярных молекул может быть полной или частичной.
Таким образом, электролитами являются соединения с ионной или полярной связью - соли, кислоты и основания. И диссоциировать на ионы они могут в полярных растворителях.
Слайд 10
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Экспериментальные исследования показали:
величина константы диссоциации сильного
электролита зависит от концентрации (т.е. к растворам сильных электролитов
неприменим закон действующих масс)
никакими методами не удалось обнаружить в растворах сильных электролитов непродиссоциировавшие молекулы
Вывод:
- сильные электролиты в растворах любых концентраций полностью диссоциируют на ионы
- закономерности, полученные для слабых электролитов, не могут применяться к сильным электролитам без соответствующих поправок.
Слайд 11
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Качественная теория сильных электролитов была разработана П.Дебаем
и Г.Хюккелем (1923).
Для сильных электролитов, полностью диссоциирующих на ионы,
даже при малых концентрациях растворов энергия электростатического взаимодействия между ионами достаточно велика, и пренебречь этим взаимодействием нельзя.
Слайд 12
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
-
+
+
+
+
+
-
-
-
-
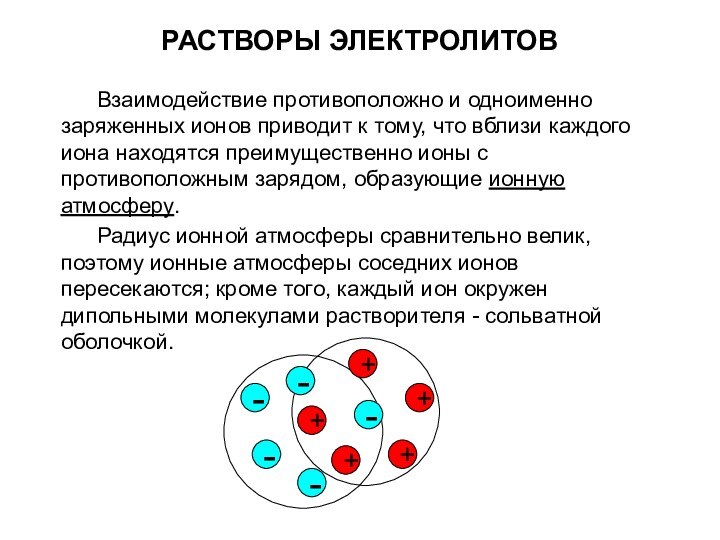
Взаимодействие противоположно и одноименно заряженных ионов приводит
к тому, что вблизи каждого иона находятся преимущественно ионы
с противоположным зарядом, образующие ионную атмосферу.
Радиус ионной атмосферы сравнительно велик, поэтому ионные атмосферы соседних ионов пересекаются; кроме того, каждый ион окружен дипольными молекулами растворителя - сольватной оболочкой.
Слайд 13
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
В растворе сильного электролита возникает подобие пространственной
структуры, что ограничивает свободу перемещения ионов и приводит к
изменению свойств раствора в том же направлении, как действовало бы уменьшение степени диссоциации.
Поэтому, определяя степень диссоциации раствора сильного электролита, получают кажущуюся степень диссоциации, т.е. величину α с поправкой на межионное взаимодействие.
Чем выше концентрация раствора, тем сильнее взаимодействие ионов, тем меньше и кажущаяся степень диссоциации сильного электролита.
Слайд 14
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Количественные расчеты характеристик растворов сильных электролитов осуществляют
с помощью понятий активности электролита аэ и активностей катионов
и анионов а+ и а- соответственно, которые равны произведению коэффициента активности f на концентрацию:
Для бинарного электролита средняя активность электролита связана с активностями ионов соотношением:
подобным же образом связан средний коэффициент активности с ионными:
Слайд 15
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Дебаем и Хюккелем был разработан метод расчета
среднего коэффициента активности сильного электролита.
Для бинарного электролита уравнение
имеет следующий вид:
где
z – заряд иона, для которого рассчитывается коэффициент активности,
I – ионная сила раствора (учитывает молярную концентрацию и заряд всех имеющихся в растворе ионов)
Слайд 16
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Ионная сила раствора равна полусумме концентраций всех
ионов, умноженных на квадрат их заряда:
Теория Дебая – Хюккеля
применима только при концентрациях, не превышающих 0,05 моль/л. Для более концентрированных растворов сильных электролитов количественной теории не существует.
Слайд 17
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Коллигативные свойства разбавленных растворов электролитов
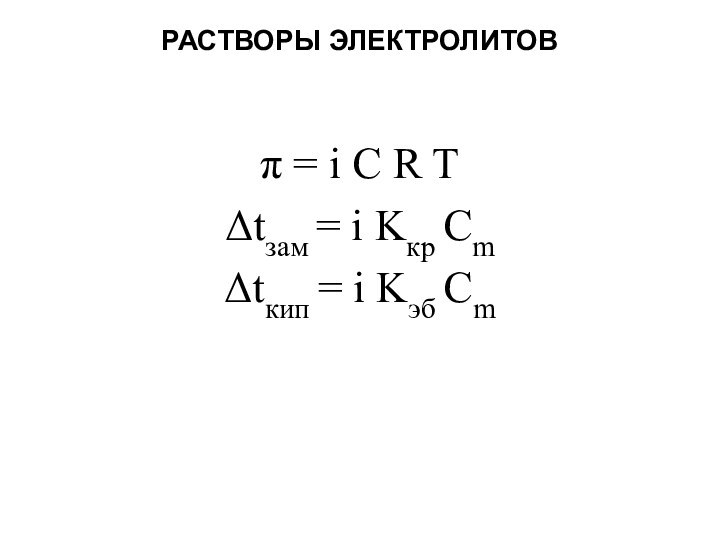
Законы Рауля не
выполняются для растворов электролитов (даже бесконечно разбавленных).
Для учета этих
отклонений Вант-Гофф внес в эти уравнения для растворов электролитов поправку – изотонический коэффициент:
изотонический коэффициент показывает, во сколько раз общее число молекул и ионов в растворе больше числа молекул до диссоциации
Слайд 18
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Изотонический коэффициент для растворов электролитов всегда больше
единицы, причем с разбавлением раствора i возрастает и стремится
к некоторому целочисленному значению.
Обобщая экспериментальные данные, Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания и осмотическое давление для них всегда больше, чем вычисленные.