Слайд 2
Цель урока
Дать общую характеристику металлов II-А группы по
положению в ПСХЭ и строению атомов.
Рассмотреть свойства и
применение кальция и его соединений.
Узнать качественную реакцию на ион кальция.
Показать значение кальция в организме человека.
Слайд 3
Проверка домашнего задания
1) Допишите схемы тех реакций,
которые протекают практически до конца:
а) Li + H2O
→ … б) NaOH(в избытке) + H3PO4 → …
в) Na2O + SO2 → г) NaOH + BaCl2→
д) LiOH + CuSO4 →
2) Решите задачу: Для получения сульфида натрия взяли 4,6г натрия и 4г серы. Какая масса сульфида натрия образовалась при этом?
Слайд 4
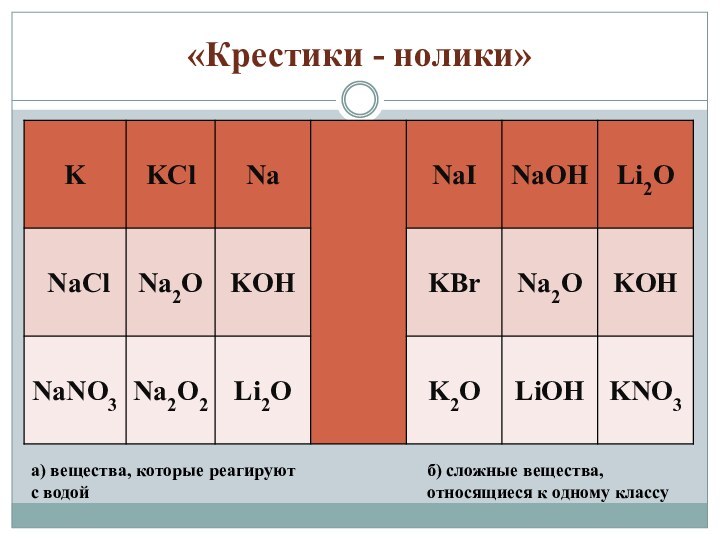
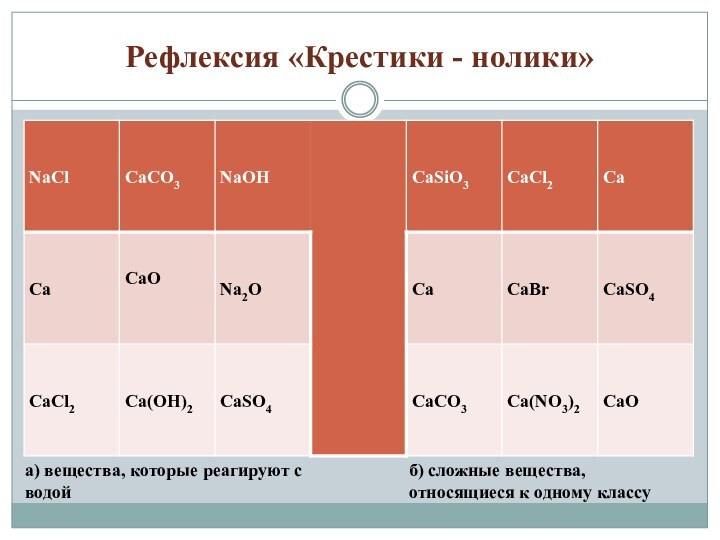
«Крестики - нолики»
а) вещества, которые реагируют с водой
б)
сложные вещества, относящиеся к одному классу
Слайд 5
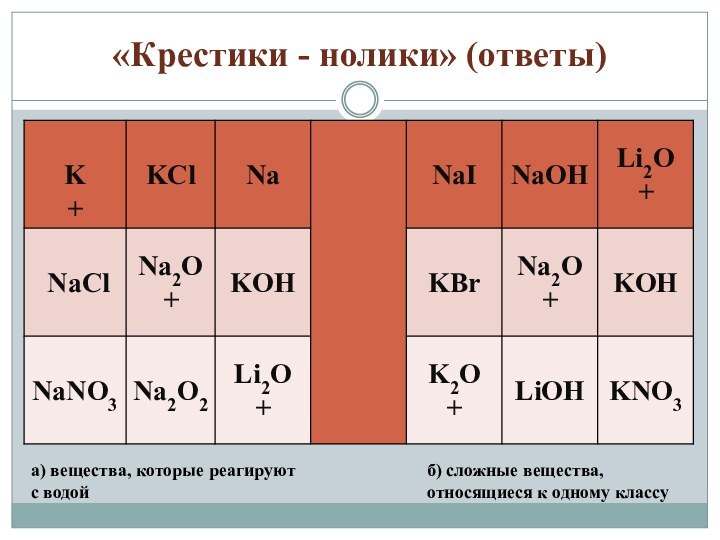
«Крестики - нолики» (ответы)
а) вещества, которые реагируют с
водой
б) сложные вещества, относящиеся к одному классу
Слайд 6
Элементы IIА группы
Дайте их характеристику по положению
в ПСХЭ. Как изменяются их свойства?
Слайд 7
Химические свойства элементов IIА группы
1. Очень реакционноспособны.
2. Обладают
положительной валентностью +2.
3. Реагируют с водой при комнатной температуре
(кроме Be) с выделением водорода.
4. Обладают большим сродством к кислороду (восстановители).
5. С водородом образуют солеобразные гидриды ЭH2.
6. Оксиды имеют общую формулу ЭО. Тенденция к образованию пероксидов выражена слабее, чем для щелочных металлов.
Слайд 8
Пользуясь учебником,
подготовьте краткие ответы на следующие вопросы
и оформите их в виде схем, формул на ватмане
1
группа – Каково строение атома кальция?
2 группа – Какова его распространённость в природе?
3 группа – Как получают кальций?
4 группа – Каковы физические свойства кальция?
Слайд 9
+20Ca 2е-,8е-,8е-,2е-
…3s23p63d0| 4s2
Умеренно твёрдый, серебристо-белый металл
Слайд 10
Нахождение в природе
Сталактиты и сталагмиты
Известняк
Кораллы
Слайд 11
Химические свойства кальция
1. Реакция с водой.
В обычных условиях
поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому
они устойчивы по отношению к воде. В отличие от них Ca, Sr и Ba растворяются в воде с образованием гидроксидов, которые являются сильными основаниями:
Mg + 2H2O ?t° MgО + H2
Ca + 2H2O ? Ca(OH)2 + H2
2. Все металлы растворяются в кислотах:
Ca + 2HCl → CaCl2 + H2
Слайд 12
Химические свойства кальция
3. Реакция с кислородом.
Все металлы образуют
оксиды RO,
барий-пероксид – BaO2:
2Mg + O2
→ 2MgO
Ba + O2 → BaO2
2Ca + O2 → 2CaO
4. С другими неметаллами образуются бинарные соединения:
Ca + H2 → CaH2(гидриды)
Ca + 2C → CaC2(карбиды)
Ca + N2 →Ca3N2(нитриды)
Слайд 13
5. Качественная реакция на катионы щелочноземельных металлов – окрашивание
пламени в следующие цвета:
Ca2+ - темно-оранжевый
Sr2+- темно-красный
Ba2+ -
светло-зеленый
Слайд 15
Важнейшие соединения кальция
CaO – негашеная известь
CaCO3 ?t° CaO
+ CO2
CaO + H2O ? Ca(OH)2
3CaO + P2O5 ?
Ca3(PO4)2
CaO + 2HNO3 ? Ca(NO3)2 + H2O
Слайд 16
Важнейшие соединения кальция
CaO + H2O ? Ca(OH)2(гашеная известь)
Ca
+ 2H2O ? Ca(OH)2 + H2
Ca(OH)2 + SO2 ?
CaSO3 + H2O
Ca(OH)2 + 2HNO3 ? Ca(NO3)2 + 2H2O
Ca(OH)2 + Na2CO3 ? CaCO3↓+ 2NaOH
Ca(OH)2 + CO2 ? CaCO3+ H2O
CaCO3 + CO2 + H2O ? Сa(HCO3)2
Сa(HCO3)2 ?t° CaCO3 + CO2 + H2O
Слайд 17
Тест на закрепление по ЩЗМ
(можно набрать 7
балов )
А-1. Распределение электронов по электронным слоям в атоме
химического элемента, заряд ядра которого +12,
1) 2,8,8,1 2) 2,8,2 3) 2,8,8,2 4) 2,8,8
А-2. В ряду Mg – Ca – Sr – Ba металлические свойства
1) усиливаются 2 ) ослабевают 3) не изменяются 4) изменяются периодически
А-3. Схеме превращения Ca0 → Ca+2 соответствует уравнение ХР
1) CaO + 2 HCl = CaCl2 + H2O
2) Ca(OH)2 + 2HCl2 = CaCl2 + 2H2O
3) Ca(OH)2 + CO2 = CaCO3↓ + H2O
4) 2Ca + O2 = 2CaO
В-4. Расположите формулы оксидов в порядке усиления основных свойств.
1) MgO 2) SrO 3) BaO 4) CaO
В-5. Установите соответствие между сокращённым ионным уравнением ХР обмена и веществами, вступающими в реакцию.
1) Ca2+ + CO32 – = CaCO3↓ А) BaCl2 и Na2SO4
2) BaCO3 + 2H+ = Ba2+ + CO2↑ + H2O Б) CaO и HNO3
3) Ba2+ + SO42 – = BaSO4↓ В) CaCl2 и Na2CO3
4) CaO + 2H+ = Ca2+ + H2O Г) BaCO3 и HCl
Слайд 18
Ответы на тест по закреплению
1) - 2
2) -
1
3) - 4
4) - 1423
5) - ВГАБ
Шкала оценок:
7
б ------------ «5»
6,5 б --------- «4»
4,3 б --------- «3»
<3 б ---------- «2»
МОЛОДЦЫ
Слайд 19
Задания для закрепления материала. (Из образцов ГИА).
Даны схемы
превращений. Напишите уравнения реакций, с помощью которых можно осуществить
указанные превращения. Для первого в 1 уравнении и для третьего во втором превращении составьте сокращённое ионное уравнение реакции.
1) Ca(OH)2 → CaCO3→ X → K2CO3
2) CaO → Ca(OH)2 → X → AgCl
Решите задачу: При обжиге 260 г известняка получили 112 г оксида кальция. Вычислите массу и массовую долю карбоната кальция, содержащегося в известняке.
Слайд 20
Роль кальция в жизни человека
Кальций является основой костной
ткани, зубов и придатков кожи – волос и ногтей.
Он принимает участие в процессе сокращения миокарда – сердечной мышцы – и таким образом влияет на сердечные показатели – пульс, давление и другие.
Кроме того, кальций участвует в работе центральной нервной системы и усвоении продуктов питания.
Слайд 21
Содержание кальция в организме человека, его значение
Демонстрация
декальцинированной кости
Слайд 22
Рекомендуемые Всемирной Организацией Здравоохранения суточные нормы потребления кальция.
Дети до 3 лет — 600 мг.
Дети от 4
до 10 лет — 800 мг.
Дети от 10 до 13 лет — 1000 мг.
Подростки от 13 до 16 лет — 1200 мг.
Молодежь от 16 и старше — 1000 мг.
Взрослые от 25 до 50 лет — от 800 до 1200 мг.
Беременные и кормящие грудью женщины — от 1500 до 2000 мг.
Слайд 23
Содержание кальция в продуктах питания:
Малое содержание кальция:
рыба
(30-90); хлеб с отрубями (60), хлеб пшеничный (37); мясо,
субпродукты, крупы (менее 50), свёкла (37), морковь (46).