- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Гидролиз органических и неорганических соединени
Содержание
- 2. Цель урока:повторить гидролиз солей, закрепить полученные знания,
- 3. Оборудование и реактивы: соли, образованные разными по
- 4. что же это за реакция –
- 5. отличие реакции гидролиза от реакции нейтрализацииГидролиз –
- 6. Как долго протекает процесс гидролиза Процесс гидролиза
- 7. Пример (Задание КИМа):К реакции гидролиза не относится:1)
- 8. Чтобы точно определить продукты гидролиза, мы должны
- 9. Пример (Задание КИМа):данные органические вещества расположить
- 10. выделяют 4 типа солей в зависимости от
- 11. алгоритм составления уравнения реакции гидролиза1)Анализ состава соли,
- 12. написать реакцию гидролиза, пользуясь алгоритмомопределить, каким основанием
- 13. 1) KNO3 + H2O
- 14. Факторы, влияющие на усиление гидролиза 1) понижение
- 15. Выводы:Усилить гидролиз можно, если: Разбавить раствор и
- 16. Изменение цвета различных индикаторов при действии растворов кислот и щелочей
- 17. Изменение цвета индикаторов в различных растворах солей
- 18. Уравнения гидролиза АlСl3АlСl3 ↔ Аl3+ + 3Сl–Н2O
- 19. Уравнения гидролиза Na2CO3Na2CO3 ↔ 2Na+ + СO32–Н2O
- 20. Уравнения гидролиза NaClNaCl ↔ Na+ + Сl–Н2O
- 21. Для большинства солей гидролиз обратимый процесс. Однако
- 22. Какую среду будут иметь водные растворы следующих
- 23. Пример с органическими соединениями Способность солей
- 24. Домашнее задание:1.Творческое задание: составить задания части А
- 25. Скачать презентацию
- 26. Похожие презентации
Цель урока:повторить гидролиз солей, закрепить полученные знания, отработать навыки составления уравнений реакции гидролиза, предсказывать продукты гидролиза, условия смещения реакции гидролиза.
























Слайд 2
Цель урока:
повторить гидролиз солей,
закрепить полученные знания,
отработать
навыки составления уравнений реакции гидролиза,
смещения реакции гидролиза.
Слайд 3
Оборудование и реактивы:
соли, образованные разными по силе
кислотами и основаниями –сульфаты, хлориды, нитраты, карбонаты, ацетаты, феноляты,
алкоголяты, индикаторная бумага, вода, пробирки.Слайд 4 что же это за реакция – гидролиз?
Гидролиз от греческого
лизис – разложение, гидро-вода
Гидролиз – это
взаимодействие ионов соли с ионами водорода Н+ или гидроксид ионами ОН- молекул воды, в результате которого образуется слабый электролит.
Слайд 5
отличие реакции гидролиза от реакции нейтрализации
Гидролиз – это
реакция, обратная реакции нейтрализации, в которой теплота поглощается и
изменяется рН среды.Гидролизу подвергаются как неорганические соли так и органические.
Слайд 6
Как долго протекает процесс гидролиза
Процесс гидролиза протекает до
тех пор, пока не установится равновесие между ионами соли,
водой и продуктами гидролизаНе следует путать гидролиз с гидратацией, где ионы соли реагируют с молекулами воды.
Слайд 7
Пример (Задание КИМа):
К реакции гидролиза не относится:
1) СНзСООNа
+ H2 O
2) K2SiO3 + H2O
3) Na2O + H2O
4) AI4C3 + H2O
Слайд 8 Чтобы точно определить продукты гидролиза, мы должны знать
силу кислот и оснований
Сильные - HNO3, H2SO4, H2SeO4
HCIO3, НСlO4, HBr,НI, HCl, HMnO4 , HIO3, HBrO3, NaOH, KOH, Ca(OH)2, Ba(OH)2, Слабые: H2CO3, H2SO3, HNO2, H3PO4, H3BO3, H2SiO3, HF, NH4OH, вода, HBrO, HCIO, HCN, H2S, HCIO2, Zn (OH)2,
AI (OH)3, Fe(OH)3
Слайд 9
Пример (Задание КИМа):
данные органические вещества расположить в
порядке усиления кислотных свойств:
С2H5OH-этиловый спирт, C6Н5ОН-фенол, СН3СООН-уксусная
кислота, СН3-СН2- СООН - пропионовая кислота, глицерин, этиленгликоль, CH2CI – COOH –хлоруксусная кислота, вода и сравнить с соляной кислотой НСl, объяснить причину усиления кислотных свойств.(Чем слабее кислота, тем сильнее гидролиз).
Слайд 10 выделяют 4 типа солей в зависимости от силы
кислоты и основания.
соли, образованные:
сильным основанием
и слабой кислотой подвергаются частичному гидролизуслабым основанием и сильной кислотой
подвергаются частичному гидролизу
слабым основанием и слабой кислотой подвергаются полному необратимому гидролизу
сильным основанием и сильной кислотой,
гидролизу не подвергаются.
Слайд 11
алгоритм составления уравнения реакции гидролиза
1)Анализ состава соли, с
целью определения силы основания и силы кислоты.
2)С ионом слабого
электролита написать уравнение взаимодействия с составными частями одной молекулы воды ( т.е. краткое ионно-молекулярное уравнение)
3)Написать полное ионно- молекулярное уравнение.
Слайд 12
написать реакцию гидролиза, пользуясь алгоритмом
определить, каким основанием и
какой кислотой (по силе) образована соль,
с
ионом слабого электролита записать реакцию.1)KNO3
2)Na2CO3
3)AICI3
4)ZnSO3
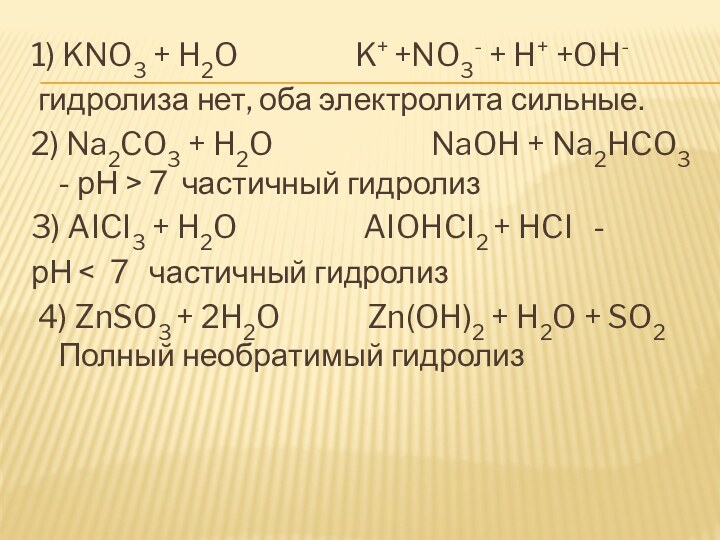
Слайд 13 1) KNO3 + H2O
K+ +NO3- + H+ +OH-
гидролиза нет, оба электролита сильные.
2) Na2CO3 + H2O NaOH + Na2HCO3 - рН > 7 частичный гидролиз
3) AICI3 + H2O AIOHCI2 + HCI -
рН < 7 частичный гидролиз
4) ZnSO3 + 2H2O Zn(OH)2 + H2O + SO2 Полный необратимый гидролиз
Слайд 14
Факторы, влияющие на усиление гидролиза
1) понижение
температуры
2) повышение температуры
3) разбавление
4) увеличение концентрации исходных веществ, продуктов,
5) добавление спирта
6) добавление кислоты H2SO4 (H+)
Слайд 15
Выводы:
Усилить гидролиз можно, если:
Разбавить раствор и нагреть.
т.е. > t0
в случае образования соли добавить кислоту,
а в случае кислоты – щелочь.Уменьшить гидролиз, т. е. сместить в сторону реакции нейтрализации можно, если:
понизить температуру, увеличить концентрацию раствора добавлением соли.
добавить к раствору один из продуктов гидролиза.
Слайд 18
Уравнения гидролиза АlСl3
АlСl3 ↔ Аl3+ + 3Сl–
Н2O ↔
Н+ + ОН–
Al3+ + 3Сl– + Н2O ↔ АlOН2+
+ 3Сl– + Н+Аl3+ + Н2O ↔ АlOН2+ + Н+
Н2O ↔ Н+ + ОН–
Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+
Аl3+ + Н2O ↔ АlOН2+ + Н+
Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет.
Слайд 19
Уравнения гидролиза Na2CO3
Na2CO3 ↔ 2Na+ + СO32–
Н2O ↔
Н+ + ОН–
____________________________________________________________________________
2Na+ + СO32– + Н2O ↔ 2Na+
+ HCO3– + ОН–СO32– + Н2O ↔ НСO3– + ОН–
Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.
Слайд 20
Уравнения гидролиза NaCl
NaCl ↔ Na+ + Сl–
Н2O ↔
Н+ + ОН–
____________________________________________________________________________
Na+ + Сl– + Н2O ↔ Na+
+ Cl– + H2OОдинаковое количество гидроксид-ионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается).
Слайд 21
Для большинства солей гидролиз обратимый процесс.
Однако есть
соли, продукты гидролиза которых выводятся из сферы реакции, и
гидролиз становится необратимым.Такими солями являются: Al2S3, (NH4)2S, Fe2(CO3)3, (NH4)2SiO3
В уравнениях необратимого гидролиза солей ставится знак равенства:
Al2S3 + 6H2O = 2Al(OH)3↓+ 3H2S↑.
Необратимому гидролизу подвергаются также бинарные соединения:
Mg3N2, CaC2, Р2S5
Необратимый гидролиз
Запишите гидролиз бинарных соединений самостоятельно
Слайд 22
Какую среду будут иметь водные растворы следующих солей:
1
вариант
2 варианта) нитрата цинка (II) а) хлорида меди (II) б) сульфата калия б) сульфита натрия в) сульфида натрия в) нитрата бария
Составьте ионное уравнение гидролиза этих солей.
Слайд 23
Пример с органическими соединениями
Способность солей подвергаться
гидролизу увеличивается в ряду
a) C2H5ONa, CH3COONa, C6H5ONa
б)
CH3 COONa, C2H5ONa, C6H5ONaв) C6H5ONa , C2H5ONa, CH3COONa
г) CH3COO-Na, C6H5O-Na , C2H5O-Na -
слабая кислота слабее еще слабее
уксусная фенол этанол