- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Периодический закон Д И Менделеева
Содержание
- 2. Периодический закон и периодическая система химических элементов Д.И. МенделееваЗЖДТВыполнила: преподаватель химии Безносова М.Ю.
- 3. История создания периодической системыВ истории каждого научного
- 4. Закон триадНачало 19 века Дж. Дальтон (основатель
- 5. В 1829 г он опубликовал таблицу,
- 6. Позднее ученые Макс Петтенкофер (1850) и Жан Батист Дюма (1857) объединили большее число элементов в триады.
- 7. Винтовая линия Шанкартуа1862 г. французский ученый Александр
- 8. Закон октав1863 – Джон Александер Рейна Ньюлендс.
- 9. Таблица Мейера1864 – немецкий ученый Юлиус Лотар
- 10. Периодический закон и его графическое отображениеД.И. Менделеев
- 11. Д.И. Менделеев 1834–1907 гг. Д.И. Менделеев сделал заключение,
- 12. Формулировка периодического закона Д.И МенделееваСвойства простых тел,
- 14. Итогом работы Менделеева в развитии периодического закона
- 15. Открытия, позволившие развить периодический закон1875 – французкий ученый П.Э. Лекок де Буабодран открыл новый элемент галий.
- 16. 1879 – шведский ученый Ларс Фредерик Нильсон окрыл новый элемент скандий..
- 17. 1886 – немецкий ученый Клеменс Александр Винклер –открыл элемент германийгерманиевый диод
- 18. 1893-1898 – английский ученый Уильям Рамзай открыл сначала инертный газ аргон, а позже и остальные.
- 19. Закон МозлиОднако несмотря на огромное естественнонаучное значение
- 20. 1913 – английский физик Генри Мозли на
- 22. Современная формулировка периодического законаСвойства химических элементов, а
- 25. Структура периодической системы химических элементов Д.И. МенделееваПериод
- 31. Группы – вертикальные ряды. Номер группы определяет
- 32. Значение периодического закона и периодической системы– установление
- 33. Причины изменения металлических и неметаллических свойств– заряды
- 34. Причины изменения металлических и неметаллических свойств в
- 36. Атом водорода имеет на внешнем (единственном) электронном
- 37. Учёные считают, что в космосе существует металлический
- 38. В сложных веществах в большинстве случаев водород
- 39. Значение периодического законаПериодическая система элементов явилась одним
- 40. Порядковый номер, массовое число.Из закона Мозли следует,
- 41. А соответствует относительной атомной массе элемента,которые приведены
- 42. Характеристики элементарных частиц
- 43. 1. Положение в п.с. (порядковый номер,
- 44. ПримерыДайте характеристику элемента № 56 по положению
- 45. Основное состояние: …6s26р0 В(Ва)=0
- 46. Ba(OH)2+2HCl=BaCl2+ Н2ОBa(OH)2+CO2= BaCO3 + Н2ОBa(OH)2 +K2SO4= BaSO4
- 47. Скачать презентацию
- 48. Похожие презентации













































Слайд 3
История создания периодической системы
В истории каждого научного открытия
можно определить два основных этапа:
установление частных закономерностей;
сам
факт открытия и признания этого открытия. До того как Д.И. Менделеев сформулировал периодический закон и предложил его графическое изображение (периодическую систему) существовали и другие попытки систематизировать знания о свойствах элементов. Ученые предлагали свои таблицы и графики элементов. Некоторые из ученых утверждали, что именно им принадлежит право первенства открытия.
Поэтому познакомимся с некоторыми главными идеями предшественников открытия периодического закона.
Слайд 4
Закон триад
Начало 19 века Дж. Дальтон (основатель атомистики)
ввел важнейшую характеристику элементов – атомный вес (позже атомная
масса). Это понятие позволило изучать и определять важнейшую характеристику – количественный состав простых и сложных тел.Первым, кто применил количественные характеристики элементов был немецкий ученый Иоганн Вольфганг Деберейнер
(1780 – 1849).
Слайд 5 В 1829 г он опубликовал таблицу, в
которой в группы по 3 элемента объединялись элементы со
сходными свойствами. Помимо химического сходства наблюдается и закономерность в отношении масс атомов.Например:
7Li, 23Na, 39K;
40Ca, 88Sr, 137Ba
Закон триад: атомная масса среднего элемента равна среднему арифметическому атомных масс двух крайних элементов
Ar(Na)= (Ar(Li)+ Ar(K))/2=(7+39)/2=23
Слайд 6 Позднее ученые Макс Петтенкофер (1850) и Жан Батист
Дюма (1857) объединили большее число элементов в триады.
Слайд 7
Винтовая линия Шанкартуа
1862 г. французский ученый Александр Эмиль
Бетье де Шанкуртуа предложил систему элементов в виде графика.
Он разместил все известные элементы в порядке увеличения массы атомов по винтовой линии, описанной вокруг цилиндра. Сходные элементы располагались друг под другом. Однако эта схема не получила конкретного анализа и развития, не указывала точное место элемента в системе.
Слайд 8
Закон октав
1863 – Джон Александер Рейна Ньюлендс. Английский
химик.
Если сходные элементы расположить друг за другом, то каждый
восьмой элемент располагается под первым, свойства элементов повторяются подобно октавам в музыке. В таком графическом изображении без пропусков исключалась возможность открытия новых элементов, кроме того многие элементы попадали на несоответствующие им места.
Слайд 9
Таблица Мейера
1864 – немецкий ученый Юлиус Лотар Мейер
Расположил
44 элемента из известных 62-х в шести столбцах в
соответствии с их валентностью по водороду. Однако эта таблица не отражала периодичности свойств. В 1870 г. статья «Природа химических элементов как функция их атомных весов», приведена графическая зависимость атомных объемов от атомных масс (кривая Мейера).
Слайд 10
Периодический закон и его графическое отображение
Д.И. Менделеев неоднократно
подчеркивал значение тех трудов, которые побуждали его к исканиям:
«…Я пользовался прежними исследованиями Дюма, Гладстона, Еттенкофера, Кремерса и Ленссена» «Я считаю, что обязан преимущественно двум: Ленссену и Дюма. Я изучил их исследования и они побудили меня искать действительный закон» Д.И. Менделеев. Собр. со.ч., т.2,1934,стр.288 и 321
Слайд 11
Д.И. Менделеев
1834–1907 гг.
Д.И. Менделеев сделал заключение, которое
получило название периодического закона:
Свойства химических элементов и образованных ими
веществ находятся в периодической зависимости от
их относительных атомных масс.
Слайд 12
Формулировка периодического закона Д.И Менделеева
Свойства простых тел, а
также формы и свойства соединений элементов находятся в периодической
зависимости от величин атомных весов элементов.Слайд 14 Итогом работы Менделеева в развитии периодического закона является
следующий вариант таблицы, который был помещен в 8 издании
Основ химии.
Слайд 15
Открытия, позволившие развить периодический закон
1875 – французкий ученый
П.Э. Лекок де Буабодран открыл новый элемент галий.
Слайд 18 1893-1898 – английский ученый Уильям Рамзай открыл сначала
инертный газ аргон, а позже и остальные.
Слайд 19
Закон Мозли
Однако несмотря на огромное естественнонаучное значение открытия
периодического закона физический смысл обобщенных Д.И.Менделеевым фактов долгое время
оставался непонятным (из-за отсутствия в 19 веке каких-либо представлений о сложности строения атома). Например, почему элемент калий(А=39,1) в таблице находится после аргона (А=39,9); никель (58,7) после кобальта (58,9); йод(126,9) после теллура (127,6). Менделеев отступил от принятого им порядка, исходя из свойств данных элементов, требовавших именно такого расположения. Таким образом он не придавал исключительного значения атомной массе, а руководствовался совокупностью свойств. Развитие теории строения атома доказало верность размещения этих элементов.Слайд 20 1913 – английский физик Генри Мозли на основании
экспериментальных данных (исследование рентгеновских спектров химических элементов) установил, что
порядковый номер элемента совпадает с зарядом ядра атомаПериодическое изменение свойств элементов зависит от их порядкового номера.
Слайд 22
Современная формулировка периодического закона
Свойства химических элементов, а также
формы и свойства соединений элементов находятся в периодической зависимости
от величины заряда ядер их атомов.А точнее свойства химических элементов определяются периодически повторяющимися однотипными электронными конфигурациями
Слайд 25
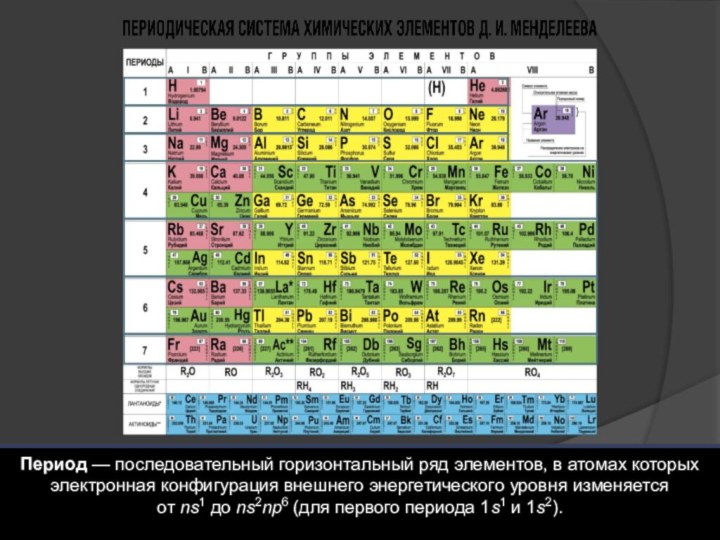
Структура периодической системы химических элементов Д.И. Менделеева
Период –
горизонтальный ряд элементов, расположенных в порядке возрастания порядкового номера
от первого s-элемента (ns1) до шестого p-элемента(ns2np6)Каждый период начинается активным щелочным металлом и заканчивается инертным газом
Периоды: 1) малые – 1-й (2 элемента), 2-й и 3-й(8 элементов)
2) большие – 4-й, 5-й (18 элементов) 6-й (32 элемента) 7-й (19 элементов, незавершенный)
Состоят из 2-х рядов: четный содержит только металлы; нечетный содержит металлы и неметаллы
Слайд 31 Группы – вертикальные ряды. Номер группы определяет максимальную
валентность элемента, максимальную положительную степень окисления, число валентных электронов
(исключения кислород и фтор)Группы делятся на подгруппы. Подгруппа – это вертикальный ряд элементов, имеющих однотипное электронное строение и являющихся электронными аналогами.
Главные подгрупы (А-подгруппы)- содержат элементы s- и p-электронных семейств, которые расположены и в больших и в малых периодах. s-элементы только металлы p-элементы металлы и неметаллы.
Побочные подгруппы(В-подгруппы) содержат элементы d-электронных семейств. В побочных подгруппах элементы только больших периодов, только металлы.
Слайд 32
Значение периодического закона
и периодической системы
– установление взаимосвязи
между элементами и объединение их по свойствам;
– расположение
элементов в естественной последовательности; – обнаружение периодичности и объяснение её причин;
– исправление и уточнение степени окисления некоторых элементов;
– предсказание существования ещё неоткрытых элементов.
Слайд 33
Причины изменения металлических
и неметаллических свойств
– заряды атомных
ядер элементов и число электронов на внешнем энергетическом уровне
атомов увеличиваются;– число энергетических уровней в атомах элементов не изменяется;
– радиус атомов уменьшается.
Слайд 34
Причины изменения металлических
и неметаллических свойств в пределах
одной группы
– увеличение зарядов атомных ядер элементов;
– увеличение числа
энергетических уровней в атомах;– увеличение радиуса атомов;
– неизменность числа электронов на внешнем энергетическом уровне.
Слайд 36 Атом водорода имеет на внешнем (единственном) электронном слое
один электрон (относится к s-элементам), ввиду чего он может
проявлять восстановительные свойства, что роднит его со щелочными металлами.До завершения внешнего электронного слоя ему не хватает одного электрона,
что указывает на способность проявлять окислительные свойства, а, следовательно, сближает атом водорода с галогенами.
Слайд 37 Учёные считают, что в космосе существует металлический водород
с соответствующей ему металлической кристаллической решеткой и электронной проводимостью.
На
Земле при обычных условиях водород представляет собой двухатомную молекулу (образована ковалентной химическая связью между атомами и является газообразным веществом). Слайд 38 В сложных веществах в большинстве случаев водород имеет
степень окисления +1, что характерно для щелочных металлов. Но
с некоторыми металлами водород способен образовывать гидриды,в которых его степень окисления равна -1,
что сближает его с галогенами.
Слайд 39
Значение периодического закона
Периодическая система элементов явилась одним из
наиболее ценных обобщений в химии. Она представляет собой как
бы конспект химии всех элементов, график по которому можно читать свойства элементов и их соединений.Система позволила уточнить положение, величины атомных масс, значение валентности некоторых элементов. На основе таблицы можно было предсказать существование и свойства еще не открытых элементов. Менделеев предсказал и описал свойства не открытых в то время элементов, которые он назвал экабор (скандий), экаалюминий (галий), экасилиций (германий).
Менделеев сформулировал периодический закон и предложил его графическое отображение, однако в то время нельзя было определить природу периодичности. Не была вскрыта причина периодичности изменения свойств и их соединений.Смысл периодического закона был выявлен позднее, в связи с открытиями по строеию атома.
Слайд 40
Порядковый номер, массовое число.
Из закона Мозли следует, что
порядковый номер элемента соответствует положительному заряду ядра атома. Атом
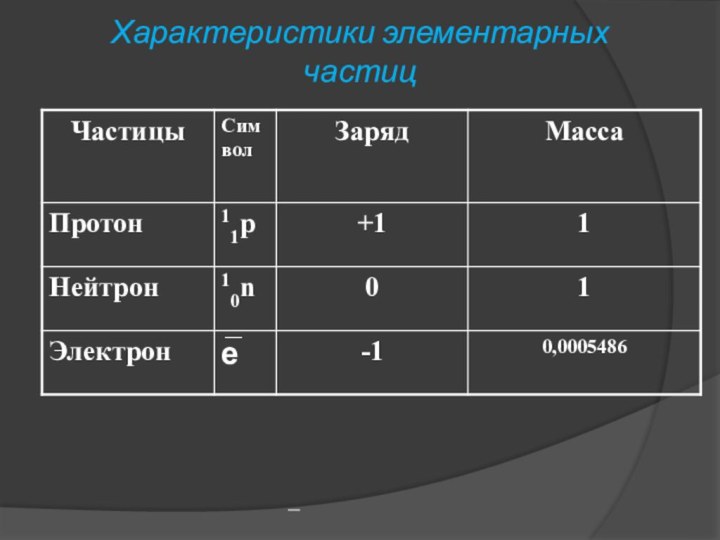
характеризуют три фундаментальных элементарных частицы. Протон, нейтрон, электрон. Ядро заряжено положительно и в нем сосредоточена основная масса. Ядро состоит из протонов и нейтронов. Сумма количества протонов и нейтронов МАССОВОЕ ЧИСЛО – А.A= N(11p)+ N(10n)
Слайд 41 А соответствует относительной атомной массе элемента,которые приведены в
п.с.: A=Ar .
Число протонов равно порядковому номеру: N(11p)=Z
Число
нейтронов: N(10n)= A- Z Число электронов равно заряду ядра число электронов равно порядковому номеру: N(e)=Z
Слайд 43 1. Положение в п.с. (порядковый номер, период,
подгруппа).
Характеристика атома элемента. Заряд ядра Z, число протонов
Nр, число нейтронов Nn, число электронов Ne. Полная электронная формула. Графическая электронная конфигурация валентных уровней в нормальном и возбужденном состояниях.Электронное семейство к которому относится элемент, металл или неметалл, формула и характер высшего оксида (основной, амфотерный, кислотный) и соответствующего ему гидрата. Реакции подтверждающие свойства оксида и гидрата.
Характеристика элемента по его положению в периодической системе.
Слайд 44
Примеры
Дайте характеристику элемента № 56 по положению в
п.с.
Элемент №56 – барий 56Ва. Ва находится в 6
периоде во второй группе главной подгруппы.2) Z=+56, N(11p)=56, N(e)=56,
N(10n)=A-N(11p)=137-56=81
Электронная формула: 1s22s22p63s23p64s23d104p65s24d105p66s2
Слайд 45
Основное состояние: …6s26р0 В(Ва)=0
Возбужденное состояние
…6s16р1 В(Ва*)=23. Ва – s-элемент, металл.
Высший оксид ВаО – основной.
Гидрат – Ва(ОН)2-основание
ВаО+Н2О=Ва(ОН)2; ВаО+СО2= ВаСО3;
ВаО+2HCl=BaCl2+ Н2О;





























