- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Характеристика АХОВ и их поражающие факторы
Содержание
- 2. Разработать классификацию АХОВ по характеру воздействия на человека
- 3. повторениеКакие вещества относятся к АХОВ?Химические вещества или
- 4. Назовите предприятия, относящиеся к ХОО.ХимическаяЦеллюлозно-бумажнаяОбороннаяНефтеперерабатывающаяНефтехимическаяПищеваяТекстильная
- 5. Назовите предприятия –потребителей АХОВ.Чёрная и цветная металлургияЦеллюлозно-бумажная промышленностьМашиностроение и оборонная промышленностьКоммунально-бытовое хозяйствоМедицинская промышленностьСельское хозяйство
- 6. Степени опасности АХОВПо степени опасности для организма
- 7. Соединения фосфора( Физиологическое действие фосфораСоединения фосфора токсичны.
- 8. ХлорХлор — ядовитый удушливый газ, при попадании
- 9. фосгенФОСГЕН, бесцветный газ с запахом прелого сена,
- 10. Фторфтор — газ (плотность 1,693 кг/м3) с
- 11. БромБРОМ, –а, м. Химический элемент, красно-бурая дымящаяся
- 12. Фтористый водород ( бесцветная, легкоподвижная, дымящая на
- 13. МышьякМышьяк — серое с металлическим блеском хрупкое
- 14. РтутьФизические и химические свойстваРтуть — серебристо-белый металл,
- 15. СвинецФизические и химические свойстваСвинец — металл синевато-серого
- 16. КадмийКАДМИЙ, [нем. Kadmium < греч. kadmeia цинковая
- 17. ЦинкЦИНК, [нем. Zink]. Химический элемент, ковкий металл
- 18. 2 класс опасностиВысокоопасные минеральные и органические кислоты:1.Серная
- 19. Соляная кислотаСОЛЯНАЯ КИСЛОТА (хлористоводородная кислота), раствор хлористого
- 20. Азотная кислотаАЗОТНАЯ КИСЛОТА, бесцветная жидкость с резким
- 21. Уксусная кислотаУКСУСНАЯ КИСЛОТА, бесцветная с резким запахом
- 22. АммиакАММИАК, [< фр. ammoniac < греч. hals
- 23. СероуглеродСЕРОУГЛЕРОД, , бесцветная летучая жидкость с эфирным
- 24. ФормальдегитФОРМАЛЬДЕГИД (муравьиный альдегид, метаналь), HCHO, бесцветный газ
- 25. ФенолФЕНОЛ (карболовая кислота, гидроксибензол), бесцветные, розовеющие на
- 26. Метиловый спиртМЕТИЛОВЫЙ СПИРТ (метанол, древесный спирт), ,
- 27. 3 класс опасностиУмеренно опасные
- 28. 4 класс опасностиМалоопасные
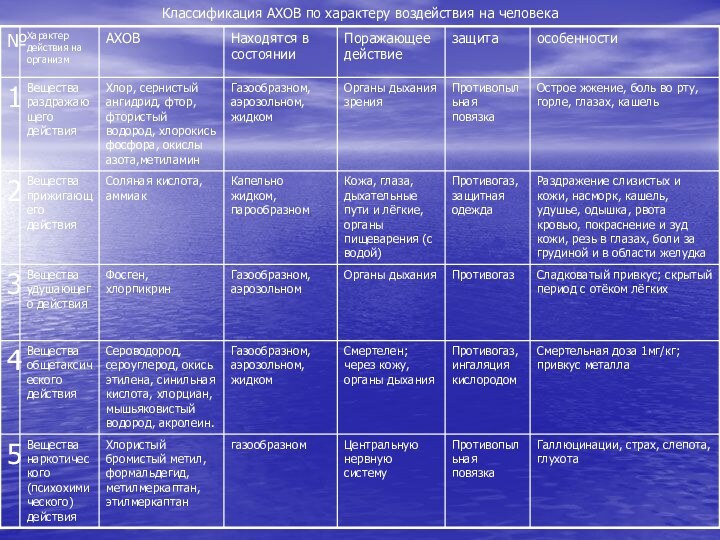
- 29. Классификация АХОВ по характеру воздействия на человека
- 30. закреплениеПочему при авариях с выбросом аммиака укрываться
- 31. Скачать презентацию
- 32. Похожие презентации
Разработать классификацию АХОВ по характеру воздействия на человека















![Характеристика АХОВ и их поражающие факторы КадмийКАДМИЙ, [нем. Kadmium < греч. kadmeia цинковая руда]. Химический элемент — серебристо-белый](/img/tmb/13/1273527/dbc68a6743b8c748b37b425be6a909ff-720x.jpg)
![Характеристика АХОВ и их поражающие факторы ЦинкЦИНК, [нем. Zink]. Химический элемент, ковкий металл синевато-белого цвета, применяемый для защиты](/img/tmb/13/1273527/e8bafc3500ed3c8e73e0582dd08009e7-720x.jpg)













Слайд 4
Назовите предприятия, относящиеся к ХОО.
Химическая
Целлюлозно-бумажная
Оборонная
Нефтеперерабатывающая
Нефтехимическая
Пищевая
Текстильная
Слайд 5
Назовите предприятия –потребителей АХОВ.
Чёрная и цветная металлургия
Целлюлозно-бумажная промышленность
Машиностроение
и оборонная промышленность
Коммунально-бытовое хозяйство
Медицинская промышленность
Сельское хозяйство
Слайд 6
Степени опасности АХОВ
По степени опасности для организма АХОВ
делятся на 4 класса:
Чрезвычайно опасные:
Синильная кислота (Синильная кислота —
бесцветная ядовитая жидкость с запахом горького миндаля, цианистый водород.)
Слайд 7
Соединения фосфора
( Физиологическое действие фосфора
Соединения фосфора токсичны. Смертельная
доза белого фосфора — 50-150 мг. Попадая на кожу,
белый фосфор дает тяжелые ожоги. Боевые отравляющие вещества зарин, зоман, табун являются соединениями фосфора. Острые отравления фосфором проявляются жжением во рту и желудке, головной болью, слабостью, рвотой. Через 2-3 суток развивается желтуха. Для хронических форм характерны нарушение кальциевого обмена, поражение сердечно-сосудистой и нервной систем. Первая помощь при остром отравлении — промывание желудка, слабительное, очистительные клизмы, внутривенно растворы глюкозы. При ожогах кожи обработать пораженные участки растворами медного купороса или соды. ПДК паров фосфора в воздухе 0,03 мг/м3. Пыль красного фосфора, попадая в легкие, вызывает пневмонию).
Слайд 8
Хлор
Хлор — ядовитый удушливый газ, при попадании в
легкие вызывает ожог легочной ткани, удушье. Раздражающее действие на
дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л. Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3. ПДК хлора в воздухе рабочих помещений 1 мг/м3, в воздухе населенных пунктов 0,03 мг/м3.Хлор в 2,5 раза тяжелее воздуха.При авариях накапливается в низинах,подвалах, тоннелях.
Хлор — один из важнейших продуктов химической промышленности. Его мировое производство составляет десятки миллионов тонн в год. Хлор используют для получения дезинфицирующих и отбеливающих средств (гипохлорита натрия, хлорной извести и других), соляной кислоты, хлоридов многих металлов и неметаллов, многих пластмасс (поливинилхлорида и других), хлорсодержащих растворителей (дихлорэтана СН2СlСН2Сl, четыреххлористого углерода ССl4 и др.), для вскрытия руд, разделения и очистки металлов и т.д. Хлор применяют для обеззараживания воды (хлорирования ) и для многих других целей.
Биологическая роль
Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов. Некоторые растения, так называемые галофиты, не только способны расти на сильно засоленных почвах, но и накапливают в больших количествах хлориды. Известны микроорганизмы (галобактерии и др.) и животные, обитающие в условиях высокой солености среды. Хлор — один из основных элементов водно-солевого обмена животных и человека, определяющих физико-химические процессы в тканях организма. Он участвует в поддержании кислотно-щелочного равновесия в тканях, осморегуляции (хлор — основное осмотически активное вещество крови, лимфы и др. жидкостей тела), находясь, в основном, вне клеток. У растений хлор принимает участие в окислительных реакциях и фотосинтезе.
Мышечная ткань человека содержит 0,20-0,52% хлора, костная — 0,09%; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Слайд 9
фосген
ФОСГЕН, бесцветный газ с запахом прелого сена, tкип
8,2 °С. Сырье в производстве красителей, мочевины, поликарбонатов и
др. В 1-ю мировую войну — отравляющее вещество удушающего действия. Смертельная концентрация в воздухе 0,1-0,3 мг/л при экспозиции 15 мин. Обладает скрытым периодом действия (2-12 ч) и кумулятивным эффектом. используемый как отравляющее вещество удушающего свойства.Признаки поражения: скрытый период 2 12 часов, слезотечение, боль в груди, затруднёное дыхание, кашель, тошнота, удушье.
Слайд 10
Фтор
фтор — газ (плотность 1,693 кг/м3) с резким
запахом. Температура кипения –188,14°C, , [< греч. phthoros гибель,
разрушение]. Бледно-желтый газ с резким запахом, самый активный из неметаллов, разрушающе действующий на многие вещества. Фтористый — содержащий ф. Фторировать — насыщать (насытить) фтором.
Слайд 11
Бром
БРОМ, –а, м. Химический элемент, красно-бурая дымящаяся на
воздухе едкая жидкость, употр. в химии, а также в
медицине, фотографии.При работе с бромом следует пользоваться защитной спецодеждой, противогазом, перчатками. ПДК паров брома 0,5 мг/м3. Уже при содержании брома в воздухе в концентрации около 0,001% (по объему) наблюдается раздражение слизистых оболочек, головокружение, а при более высоких концентрациях — спазмы дыхательных путей, удушье. При попадании в организм токсическая доза составляет 3 г, летальная — от 35 г. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух, для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Дальнейшее лечение должно проводиться под наблюдением врача. Жидкий бром при попадании на кожу вызывает болезненные ожоги.
Из-за высокой химической активности и ядовитости как паров брома, так и жидкого брома его следует хранить в стеклянной, плотно укупоренной толстостенной посуде.
Слайд 12 Фтористый водород ( бесцветная, легкоподвижная, дымящая на воздухе
жидкость с резким запахом. Применяют в производстве фтора, фторорганических
соединений. Очень ядовит.Хлористый водород (бесцветный, дымящий на воздухе газ с резким запахом.Используют в производстве соляной кислоты)
Соединения металлов: мышьяка, ртути, свинца,кадмия,цинка и др.
Слайд 13
Мышьяк
Мышьяк — серое с металлическим блеском хрупкое вещество
Физиологическое
действие
Мышьяк и все его соединения ядовиты. При остром отравлении
мышьяком наблюдаются рвота, боли в животе, понос, угнетение центральной нервной системы. Помощь и противоядия при отравлении мышьяком: прием водных растворов Na2S2O3. Промывание желудка, прием молока и творога; специфическое противоядие — унитиол. ПДК в воздухе для мышьяка 0,5мг/м3. Работают с мышьяком в герметичных боксах, используя защитную спецодежду. Из-за высокой токсичности соединения мышьяка использовались Германией как отравляющие вещества в Первую мировую войну.На территориях, где в почве и воде избыток мышьяка, он накапливается в щитовидной железе у людей и вызывает эндемический зоб.
Слайд 14
Ртуть
Физические и химические свойства
Ртуть — серебристо-белый металл, в
парах бесцветный. Единственный жидкий при комнатной температуре металл.
Физиологическое действие
Ртуть
и ее соединения высокотоксичные. Пары и соединения ртути накапливаясь в организме человека, сорбируются легкими, попадают в кровь, нарушают обмен веществ и поражают нервную систему. Признаки ртутного отравления проявляются уже при содержании ртути в концентрации 0.0002–0.0003 мг/л. Пары ртути фитотоксичны, ускоряют старение растений.При работе с ртутью и ее соединениями следует предотвращать ее попадание в организм через дыхательные пути и кожу. Хранят в закрытых сосудах.
Слайд 15
Свинец
Физические и химические свойства
Свинец — металл синевато-серого цвета
с кубической гранецентрированной решеткой, а = 0,49389 нм. Плотность
11,3415 кг/дм3, температура плавления 327,50°C кипения 1715°C. Свинец мягок, легко прокатывается в тончайшие листы, свинцовую фольгу. Хорошо поглощает рентгеновские и бета-лучи. Химически свинец довольно инертен. Во влажном воздухе поверхность свинца тускнеет, покрываясь сначала оксидной пленкой, которая постепенно переходит в основной карбонатДо 45% свинца идет на изготовление пластин кислотных аккумуляторов. 20% — на изготовление проводов, кабелей и покрытий к ним. Экраны из свинца служат для защиты от радиоактивного и рентгеновского излучения. Из свинца и его сплавов изготавливают контейнеры для хранения радиоактивных веществ. Сплавы свинца используют для изготовления типографских шрифтов, из сплавов свинца изготавливают сердечники пуль, шрапнель, дробь. 5-20% свинца идет на изготовление тетраэтилсвинца (ТЭС) , который добавляют к бензину для повышения октанового числа. Свинец используется в производстве пигментов, для строительства сейсмостойких фундаментов.
Свинец и его соединения — токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение. ПДК в атмосферном воздухе соединений свинца 0,003 мг/м3, в воде 0,03 мг/л, почве 20,0 мг/кг. Выброс свинца в Мировой океан 430-650 тысяч т/год.
Слайд 16
Кадмий
КАДМИЙ, [нем. Kadmium < греч. kadmeia цинковая руда].
Химический элемент — серебристо-белый металл, применяемый в сплавах, для
защиты покрытий, в атомной энергетике и т. п. Кадмиевый — из кадмия, с применением кадмия.Применение
40% производимого кадмия используется для нанесения антикоррозионных покрытий на металлы. 20% кадмия идет на изготовление кадмиевых электродов, применяемых в аккумуляторах, нормальных элементах Вестона. Около 20% кадмия используется для производства неорганических красящих веществ, специальных припоев, полупроводниковых материалов и люминофоров. 10% кадмия — компонент ювелирных и легкоплавких сплавов, пластмасс.
Физиологическое действие
Пары кадмия и его соединения токсичны, причем кадмий может накапливаться в организме. В питьевой воде ПДК для кадмия 10 мг/м3. Симптомы острого отравления солями кадмия — рвота и судороги. Растворимые соединения кадмия после всасывания в кровь поражают центральную нервную систему, печень и почки, нарушают фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
Слайд 17
Цинк
ЦИНК, [нем. Zink]. Химический элемент, ковкий металл синевато-белого
цвета, применяемый для защиты стали от коррозии, для изготовления
сплавов. Цинковый — из цинка, с цинком; относящийся к цинку.Применение
Основная часть производимого цинка расходуется на изготовление антикоррозионных покрытий железа и стали. Цинк применяют в аккумуляторах и сухих элементах питания. Листовой цинк используют в типографском деле. Сплавы цинка (латунь, нейзильбер и другие) применяются в технике. Цинк служит пигментом в цинковых белилах. Соединения цинка являются полупроводниками. Раствором хлорида цинка пропитывают железнодорожные шпалы, предохраняя их от гниения.
Фосфид и оксид цинка ядовиты. Попадание в организм растворимых солей цинка приводит к расстройству пищеварения, раздражению слизистых оболочек. ПДК для цинка в воде 1,0 мг/л.
Слайд 18
2 класс опасности
Высокоопасные минеральные и органические кислоты:
1.Серная кислота
(СЕРНАЯ
КИСЛОТА, сильная двухосновная кислота. Безводная серная кислота — бесцветная
маслянистая жидкость, плотность 1,9203 г/см3, tпл 10,3 °С, tкип 296,2 °С. С водой смешивается во всех отношениях. Концентрированная серная кислота реагирует почти со всеми металлами, образуя соли — сульфаты.Серная кислота — один из основных продуктов химической промышленности. Идет на производство минеральных удобрений (суперфосфат, сульфат аммония), различных кислот и солей, лекарственных и моющих средств, красителей, искусственных волокон, взрывчатых веществ. Применяется в металлургии (разложение руд, напр. урановых), для очистки нефтепродуктов, как осушитель и др. Мировое производство 139 млн. т. (нач. 1990-х гг.).
Слайд 19
Соляная кислота
СОЛЯНАЯ КИСЛОТА (хлористоводородная кислота), раствор хлористого водорода
в воде; сильная кислота. Бесцветная, «дымящая» на воздухе жидкость
(техническая соляная кислота желтоватая из-за примесей ). Максимальная концентрация (при 20 °С) 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в гидрометаллургии и гальванопластике, для очистки поверхности металлов при паянии и лужении, для получения хлоридов цинка, марганца, железа и др. металлов. Составная часть желудочного сока; разведенную соляную кислоту назначают внутрь главным образом при заболеваниях, связанных с недостаточной кислотностью желудочного сокаПризнаки поражения
Затруднённое дыхание, ожоги кожи и слизистой, кашель, одышка, рвота кровью, боль в грудной и в области желудка. Смертельная концентрация 6 мг. На 1 литр.Признаки появляются через 30 минут
Слайд 20
Азотная кислота
АЗОТНАЯ КИСЛОТА, бесцветная жидкость с резким удушливым
запахом; плотность 1,513 г/см3, tпл —41,59 °C, tкип 82,6
°C. С водой смешивается во всех отношениях. В промышленности получают каталитическим окислением аммиака. Применяют для получения удобрений, нитратов целлюлозы, красителей, серной кислоты, для травления металлов и полупроводниковых материалов, как окислитель ракетного топлива, компонент «нитрующей смеси» (с серной кислотой). Соли и эфиры азотной кислоты — нитраты.
Слайд 21
Уксусная кислота
УКСУСНАЯ КИСЛОТА, бесцветная с резким запахом жидкость.
Для безводной, т. н. «ледяной», кислоты tпл 16,75 °С,
tкип 118,1 °С. Получают окислением ацетальдегида и другими методами, пищевую уксусную кислоту — уксусно-кислым брожением спиртовых жидкостей. Применяют в пищевой промышленности, для получения лекарственных и душистых веществ, хлоруксусных кислот, как растворитель, напр. в производстве ацетата целлюлозы. Соли и эфиры уксусной кислоты наз. ацетатами.
Слайд 22
Аммиак
АММИАК, [< фр. ammoniac < греч. hals ammōniakos
— назв. нашатыря, который получали в оазисе Аммониум в
Ливийской пустыне]. хим. Химическое соединение азота с водородом (NH3) — бесцветный газ с резким запахом, легче воздуха. С воздухам образует взрывоопасную смесь.Применение
В промышленности аммиак используют при получении азотной кислоты HNO3, в производстве азотных минеральных удобрений, в холодильных установках в качестве хладагента. Аммиачная вода является азотным удобрением. Нашатырный спирт используют в медицине.
Физиологическое действие
Аммиак ядовит, ПДК 20 мг/м3. Жидкий аммиак вызывает сильные ожоги. При содержании в воздухе 0,5% по объему аммиак сильно раздражает слизистые оболочки. При остром отравлении поражаются глаза и дыхательные пути. При хроническом отравлении — расстройство пищеварения, катар верхних дыхательных путей, ослабление слуха.





























