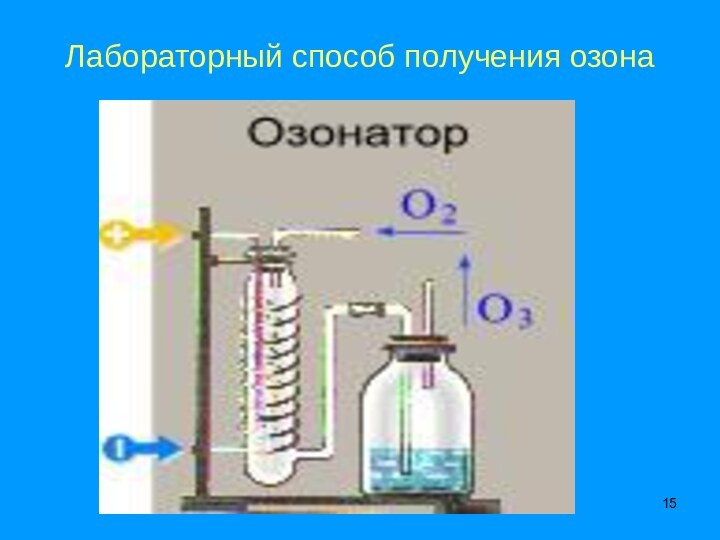
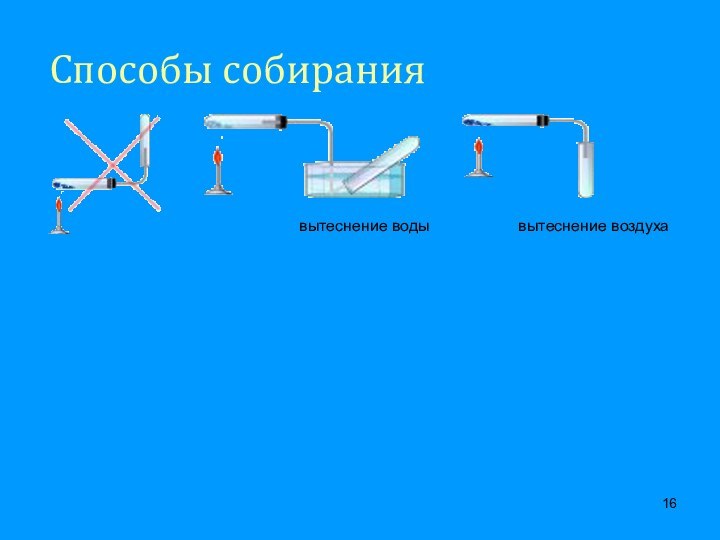
подгруппе, II периоде, порядковый номер №8,
Ar = 16.2. Строение атома:
P11 = 8; n01 = 8; ē = 8
валентность II, степень окисления -2
(редко +2; +1; -1).
3. Входит в состав оксидов, оснований, солей, кислот, органических веществ, в том числе живых организмов- до 65% по массе.
Кислород как элемент