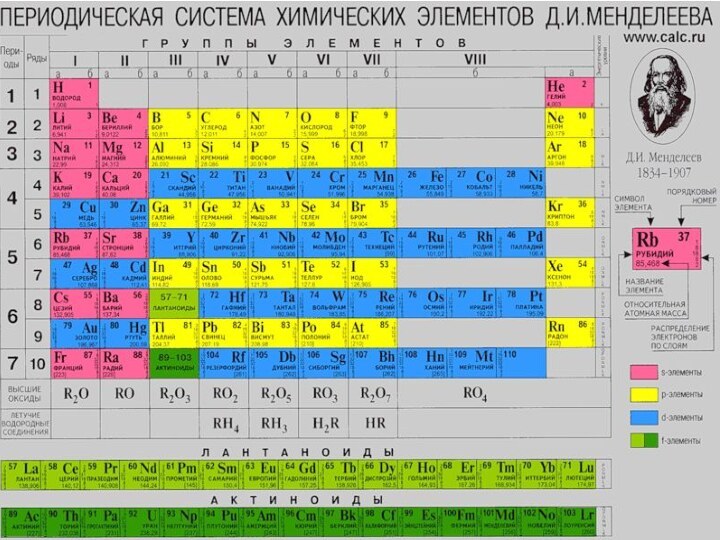
Слайд 2
Из общего числа известных в настоящее время элементов
в периодической таблице Менделеева 32 являются d-элементами.
d-элементы появляются в
4-ом периоде периодической системы. Эти элементы имеют на внешней энергетическом уровне 2 или 1 – s ē и различаются числом электронов на соседнем с внешним уровне. По мере увеличения порядкового номера у d-элементов происходит достройка предпоследнего энергетического уровня
d-электронами.
Слайд 3
Все d-элементы являются металлами, степени окисления которых в
соединениях различны. Их наибольшая степень окисления отвечает номеру группы,
в которой расположен элемент (кроме Cu, у которого высшая степень окисления +2, Аu, у которого высшая степень окисления +3)
Валентность d-элементов определяется как s-электронами внешнего уровня, так и d- электронами энергетического уровня предшествующего внешнему.
Слайд 4
Высшие оксиды d-элементов с V по VIII группы
обладают кислотными свойствами, низшие – основными, промежуточные - амфотерными.
Так, MnO – основной, MnO2 – амфотерный, а MnO3 и Mn2O7 - кислотные оксиды.
Слайд 5
Способность к кислотообразованию и степень диссоциации кислородных кислот
у d-элементов увеличивается также как у s- и p-элементов
– слева направо и снизу вверх в периодической системе.
У d-элементов имеются свободные d, s или p – орбитали. Число их может увеличиваться за счет спаривания одиночных электронов d-орбиталей. Катионы и атомы этих элементов могут являться акцепторами неподеленных электронных пар, чем и объясняется склонность d-элементов к комплексообразованию.
Слайд 6
Для большинства d-элементов характерной особенностью является то, что
их соединения окрашены. Эта особенность связана с тем, что
возбуждение d-элементов при образовании соединений происходит благодаря поглощению квантов света видимой области спектра.
Слайд 9
Надо отметить, что энергия ионизации увеличивается сверху вниз.
Вольфрам вследствие лантаноидного сжатия имеет атомный и ионный радиус
близкий к молибдену. Поэтому Mo и W по своим свойствам ближе друг к другу, чем к Сr. Активность в подгруппе уменьшается от Сr к W в отличие от главных подгрупп. В соединениях Сr, Mo, W проявляют все степени окисления от 0 до +6.
Слайд 10
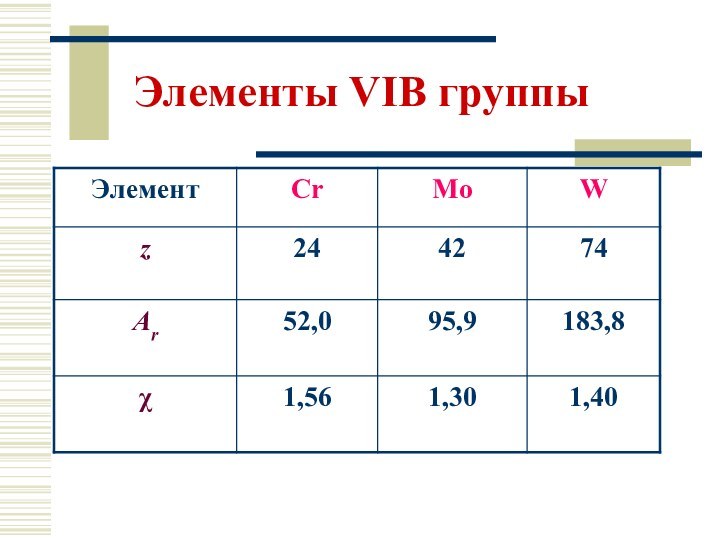
Электронное строение
Cr: […] 4s1 3d 5 4p0
Mo: […] 5s1 4d 55p0
W: […] 6s 2
4f 145d 46p0
Ст. окисления: 0, +II, +III, +IV, +VI (Cr); 0, +IV, +VI (Mo, W)
Валентность (КЧ): Cr 6; Mo 6, 8; W 6, 8, 9;
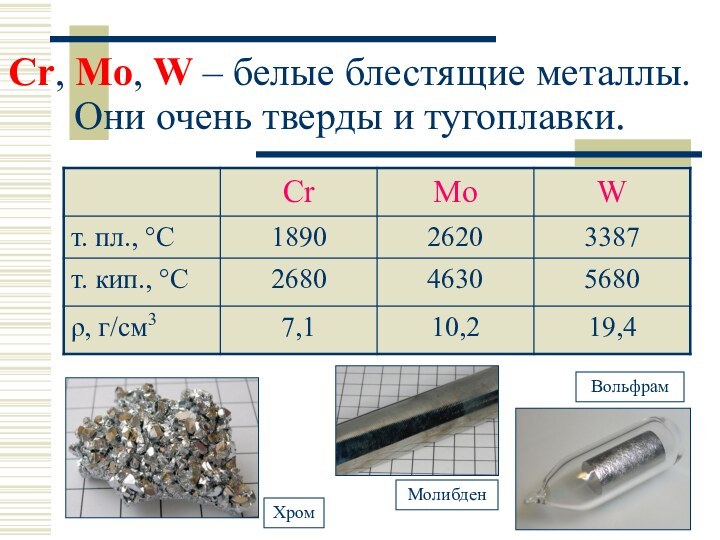
Cr, Mo:
Слайд 11
Сr, Mo, W – белые блестящие металлы. Они
очень тверды и тугоплавки.
Слайд 13
Химически при комнатной температуре эти элементы мало реакционноспособны.
В реакцию с O2, галогенами, S, N, P, Si
вступают только при нагревании.
Конц. HNO3 быстро окисляет их поверхность и образовавшаяся пленка оксида защищает металл от дальнейшего её воздействия, т.е. происходит (пассивация) Me.
Слайд 14
Надо отметить, что Сr растворяется в разбавленных растворах
HCl, H2SO4, а Mo и W – в горячей
HNO3 и «царской водке».
Слайд 15
Простые вещества
Cr + 2H3O+ + 4H2O → [Cr(H2O)6]2+
+ H2↑
Mo(W) + H3O+ ≠
Слайд 16
Простые вещества
Кислоты-окислители (пассивация на холоду):
ЭVIВ
+ HNO3(конц), H2SO4(конц) ≠
Э (Mo,W) + 2HNO3 +
8HF → Н2[ЭVIF8] + 2NO↑ + 4H2O
Э + 8HF – 6e– = [ЭF8]2– + 2H+
NO3 – + 4H+ + 3e– = NO + 2H2O
Э (Cr,Mo,W) + 3NaNO3 + 2NaOH →
→ Na2ЭVIO4 + 3NaNO2 + H2O
Cr + NaOH (р) ≠
Слайд 17
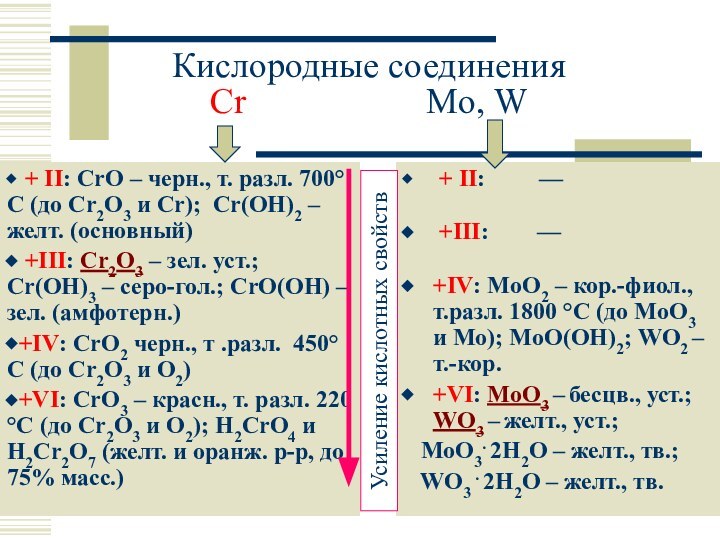
Кислородные соединения
Cr
Mo, W
+ II: CrO –
черн., т. разл. 700°C (до Cr2O3 и Cr); Cr(OH)2 – желт. (основный)
+III: Cr2O3 – зел. уст.; Cr(OH)3 – серо-гол.; CrO(OH) – зел. (амфотерн.)
+IV: CrO2 черн., т .разл. 450°C (до Cr2O3 и O2)
+VI: CrO3 – красн., т. разл. 220 °C (до Cr2O3 и O2); H2CrO4 и H2Cr2O7 (желт. и оранж. р-р, до 75% масс.)
+ II: —
+III: —
+IV: MoO2 – кор.-фиол., т.разл. 1800 °C (до MoO3 и Mo); MoO(OH)2; WO2 – т.-кор.
+VI: MoO3 – бесцв., уст.; WO3 – желт., уст.;
MoO3. 2H2O – желт., тв.;
WO3 . 2H2O – желт., тв.
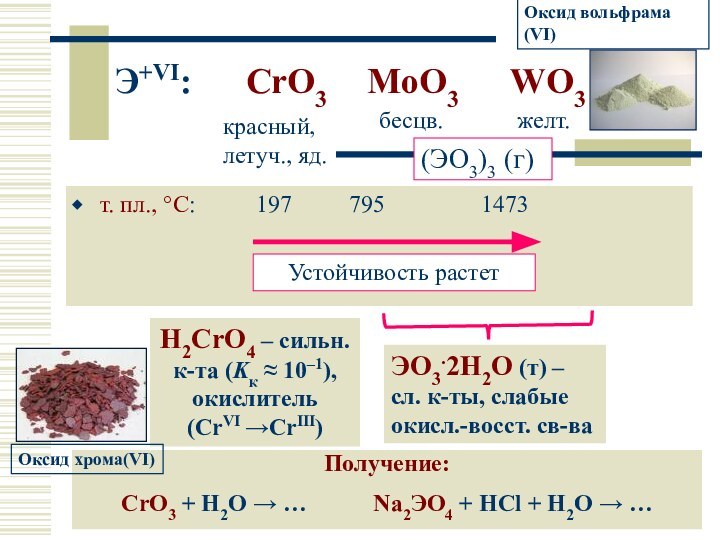
Слайд 18
Э+VI: CrO3 MoO3 WO3
т.
пл., °С: 197 795
1473
красный, летуч., яд.
бесцв.
желт.
(ЭO3)3 (г)
H2CrO4 – сильн. к-та (Kк ≈ 10–1), окислитель (CrVI →CrIII)
Получение:
CrO3 + H2O → … Na2ЭO4 + HCl + H2O → …
Слайд 19
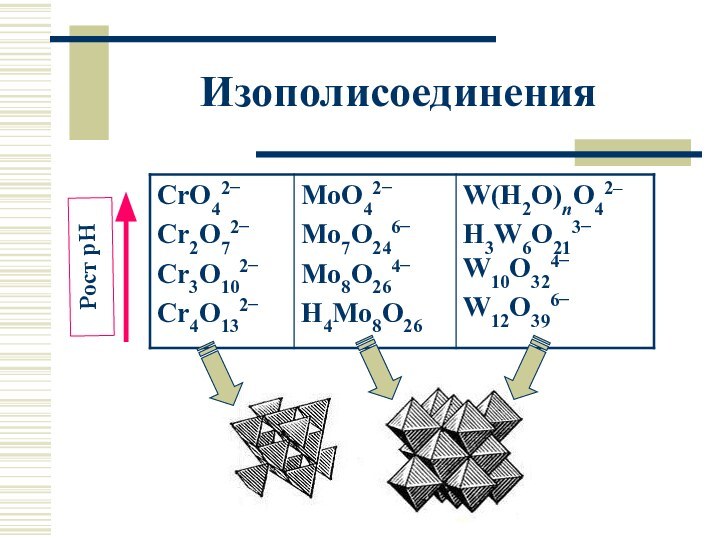
Изополисоединения (ст.ок. +VI)
2CrO42− + 2H3O+ ⮀
Cr2O72− + 3H2O;
3Cr2O72− + 2H3O+ ⮀ 2Cr3O102−
+ 3H2O
………….
Cr2O72− + 2OH– ⮀ 2CrO42− + H2O;
Слайд 21
Пероксокомплексы
Cr2O72− + 4H2O2 + 2H3O+ + L
→
→ 2[CrVI(L)O(O22−)2] + 7H2O
голубого цвета
(экстракция органическим р-лем)
КЧ
6; пентагональная пирамида
L – эфир, пиридин …
Слайд 22
Распространение в природе и важнейшие минералы
21. Cr 0,019%
масс.
39. Mo 1·10–3%
27. W 7·10–3%
Редкие эл-ты
хромит Fe(CrO2)2 хромистый железняк
крокоит
PbCrO4
молибденит MoS2
вольфрамит (Mn, Fe)WO4
шеелит CaWO4
Слайд 23
Минералы
гюбнерит MnWO4
повеллит CaMoO4
молибдошеелит Ca(W,Mo)O4
ферберит FeWO4
Хром входит в состав минералов:
александрит, рубин, аквамарин, изумруд, уваровит Ca3Cr2III(SiO4)3 из семейства гранатов
Слайд 24
Получение
Cr2O3 + 2Al = 2Cr + Al2O3
(t°)
Fe(CrO2)2 + 4C = Fe + 2Cr + 4CO
феррохром
WO3 + 3H2 = W + 3H2O (t°)
MoO3 + 3H2 = Mo + 3H2O (t°)
Слайд 25
Для получения чистого хрома сначала получают Cr2O3 (III),
а затем восстанавливают его алюмотермическим способом:
Cr2O3 + 2Al →
2Cr + Al2O3
Слайд 26
Химия хрома. Cr(II)
Соединения Cr(II) можно получить:
Cr + 2HCl
→ CrCl2 + H2
Cr+2 неустойчивые в
водной среде соединения и быстро окисляются кислородом воздуха в Cr+3:
4CrCl2 + 4HCl + O2 → 4CrCl3 + 2H2O
Слайд 27
Для Cr (II) характерен Cr(OH)2, который образуется:
CrCl2 +
2NaOH → Cr(OH)2 + 2NaCl
желт. цв.
Cr(OH)2 взаимодействует только с кислотами и кислотными оксидами:
Cr(OH)2 + 2HCl → CrCl2 + 2H2O
Cr(OH)2 + SO3 → CrSO4 + H2O
Слайд 28
Cr 2+ образует аквакомплексные соединения [Cr(H2O)6]2+, в состав
которых входит ион гексааквахрома (II), придающий раствору синюю окраску.
Слайд 29
Соединения Cr (III).
Одним из соединений хрома (III) является
Cr2O3 – оксид хрома (III) - тугоплавкое вещество зеленого
цвета, применяется для приготовления клеевой и масляной красок служит для окраски стекла и фарфора.
Cr2O3 – амфотерный оксид. Получают:
t
(NH4)Cr2O7 Cr2O3 + N2 + 4H2O
t
2Cr(OH)3 Cr2O3 + 3H2O
Слайд 30
Следующее соединение, характерное для Cr(III) это Cr(OH)3
Получают:
CrCl3 +
3NaOH Cr(OH)3 + 3NaCl
Cr(OH)3 – амфотерное
основание, выпадает в виде осадка синевато-серого цвета.
Слайд 31
Cr(OH)3 растворяется в кислотах с образованием аквакатионных комплексов
[Cr(H2O)6]3+ фиолетового цвета:
Cr(OH)3 + 3HCl + 3H2O
[Cr (H2O)6] Cl3
и в щелочах с образованием гидроксохроматов зеленого цвета:
Cr(OH)3 + 3NaOH Na3[Cr(OH)6]
Из этих реакций видно, что хром в комплексных соединениях имеет к.ч. = 6
Слайд 32
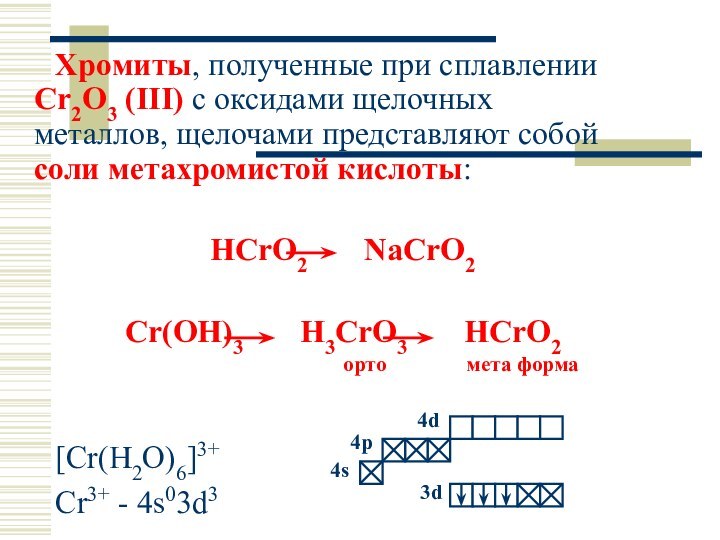
Хромиты, полученные при сплавлении Cr2O3 (III) с оксидами
щелочных металлов, щелочами представляют собой соли метахромистой кислоты:
HCrO2
NaCrO2
Cr(OH)3 H3CrO3 HCrO2
орто мета форма
[Cr(H2O)6]3+
Cr3+ - 4s03d3
4s
4p
4d
3d
Слайд 33
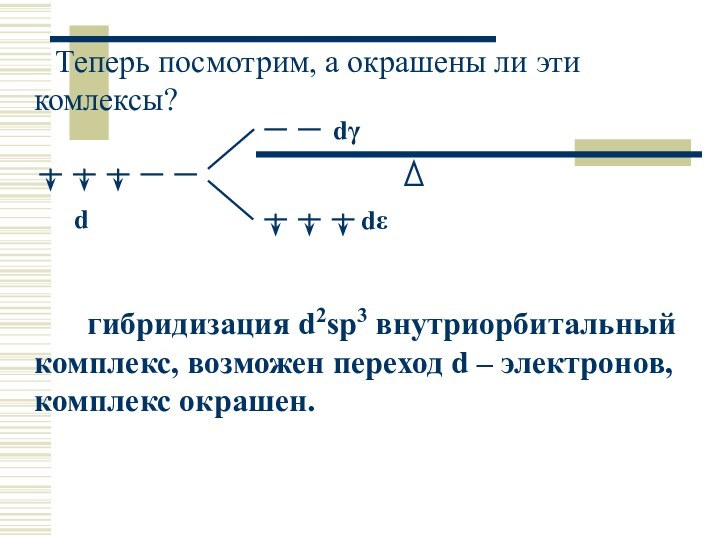
Теперь посмотрим, а окрашены ли эти комлексы?
гибридизация d2sp3 внутриорбитальный комплекс, возможен переход d – электронов,
комплекс окрашен.
dε
dγ
d
Слайд 34
Окраска комплексов связана с изомерией – гидратная изомерия
хрома:
[Cr(H2O)6]Cl3 – сине-фиолетовая
[Cr(H2O)5Cl]H2OCl2 – светло-зеленая
[Cr(H2O)4Cl2]Cl(H2O)2 – темно-зеленая
Дигидрат хлорид
дихлоротетрааква хрома (III)
Слайд 35
Для Cr(III) характерно образование солей с сильными кислотами
CrCl3; Cr2(SO4)3.
Из солей Cr(III) самой распространенной солью является хромокалиевые
квасцы – КCr2(SO4)2·12H2O – синефиолетовые кристаллы, используемые в кожевенной и текстильной промышленности.
Соли Cr(III) подвергаются гидролизу по катиону [Cr(H2O)6]3+:
CrCl3 Cr3+ + 3Cl-
[Cr(H2O)6]3+ + H2O ↔ [Cr(H2O)5OH]2+ + H3O+
Слайд 36
Со слабыми кислотами Cr(III) солей не образует. При
попытке получить в водном растворе обменной реакцией Cr2(CO3)3 вследствие
гидролиза выделяется Cr(OH)3 в осадок:
2CrCl3 + 3Na2CO3 + 3H2O
2Cr(OH)3 + 6NaCl + 3CO2
Слайд 37
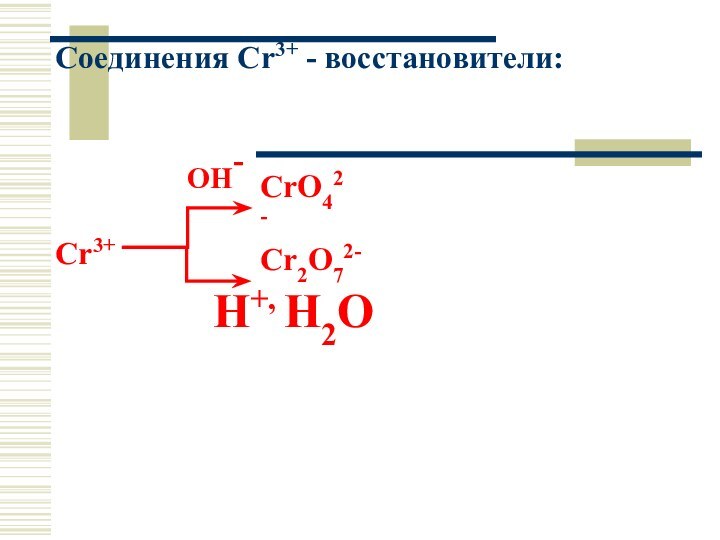
Соединения Cr3+ - восстановители:
OH-
Cr3+
H+, Н2О
Cr2O72-
CrO42-
Слайд 38
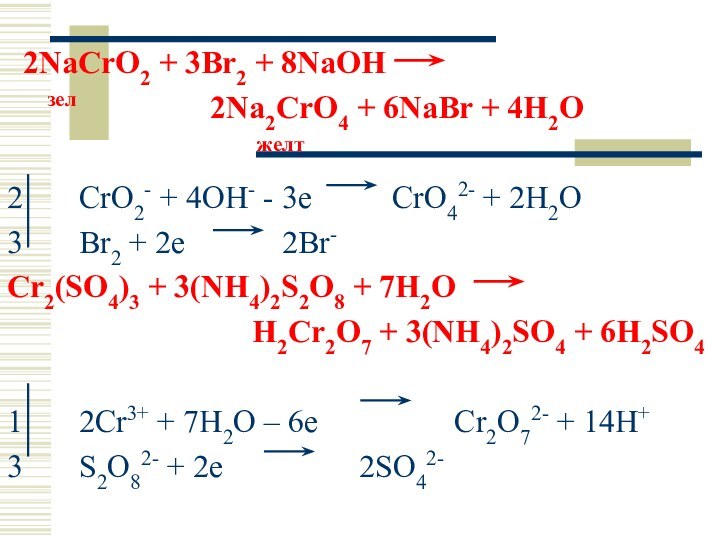
2NaCrO2 + 3Br2 + 8NaOH
зел
2Na2CrO4 + 6NaBr + 4H2O
желт
2 CrO2- + 4OH- - 3e CrO42- + 2H2O
3 Br2 + 2e 2Br-
Cr2(SO4)3 + 3(NH4)2S2O8 + 7H2O
H2Cr2O7 + 3(NH4)2SO4 + 6H2SO4
1 2Cr3+ + 7H2O – 6e Cr2O72- + 14H+
3 S2O82- + 2e 2SO42-
Слайд 39
Соединения Cr (VI)
Важнейшими соединениями Cr(VI) являются CrO3 –
оксид хрома (VI) – хромовый ангидрид – кристаллическое вещество
темно-красного цвета и соли отвечающих ему кислот:
H2CrO4 – хромовая кислота
H2Cr2O7 – двухромовая кислота
Обе кислоты существуют только в водном растворе, но соли их достаточно стойки.
Слайд 40
Соли хромовой кислоты – хроматы, двухромовой – дихроматы.
Хроматы – желтого цвета, дихроматы – оранжевого. При подкислении
раствора соли K2CrO4 чисто желтая окраска раствора сменяется на оранжевую, вследствие перехода ионов CrO42- в ионы Cr2O72-. Из полученного раствора можно выделить соль K2Cr2O7 в виде оранжево-красных кристаллов.
Слайд 41
Переход выражается уравнением:
2CrO42- + 2H+
Cr2O72- + H2O
Реакция обратима. Это значит, что при
растворении дихроматов образуется хотя и незначительное кол-во H+ и CrO42-.
Слайд 42
Если к раствору дихромата прибавить гидроксид, то OH-
- ионы будут связывать находящиеся в растворе H+, равновесие
смещается и в результате дихромат превращается в хромат
Cr2O72- + 2OH- 2CrO42- + H2O
Следовательно, хроматы устойчивы в щелочной среде, дихроматы – в кислой.
Слайд 43
Хроматы щелочных металлов получаются путем окисления соединений Cr(III)
в присутствии щелочи. Например, при действии брома на раствор
хромита натрия (реакция выше) или сплавлением соединений Cr(III) с окислительными щелочными смесями:
t
Cr2(SO4)3 + 3KNO3 + 5K2CO3
зел 2K2CrO4 + 3K2SO4 + 3KNO2 + 5CO2
желт
Слайд 44
Хроматы щелочных металлов хорошо растворимые в воде соединения.
Растворимость хроматов щелочно-земельных металлов уменьшается.
Хроматы и дихроматы – сильные
окислители
K2Cr2O7(30г) + H2SO4 (1л) – хромпик
Слайд 45
Разложение дихромата аммония
(NH4)2Cr2O7 = Cr2O3 + N2 +
4H2O
«Дихроматный вулкан» (видеофрагмент)
Слайд 46
В кислых и щелочных растворах соединения хрома (III)
и Cr(VI) существуют в разных формах:
кислая среда – Cr3+
или Cr2O72-
щелочная среда – CrO2-, [Cr(OH)6]3- или CrO42-
Поэтому взаимопревращение соединений Cr(III) и Cr(VI) протекает по-разному в зависимости от реакции раствора.
Слайд 47
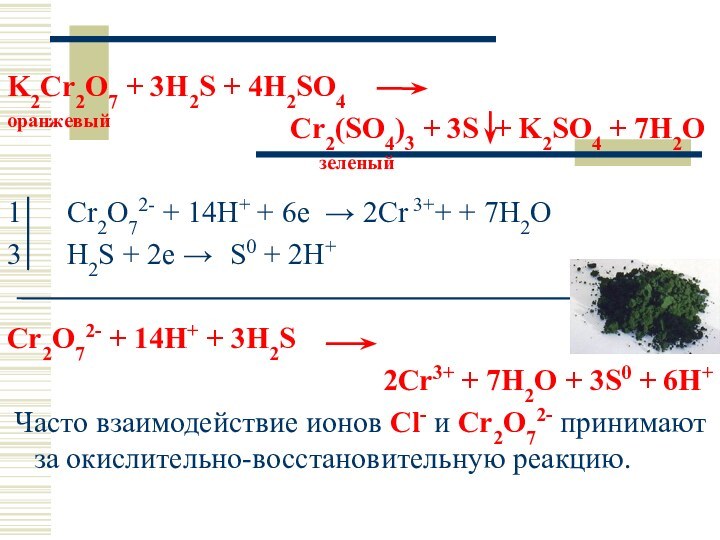
K2Cr2O7 + 3H2S + 4H2SO4
оранжевый
Cr2(SO4)3 + 3S + K2SO4 + 7H2O
зеленый
1 Cr2O72- + 14H+ + 6e → 2Cr 3++ + 7H2O
3 H2S + 2e → S0 + 2H+
Cr2O72- + 14H+ + 3H2S
2Cr3+ + 7H2O + 3S0 + 6H+
Часто взаимодействие ионов Cl- и Cr2O72- принимают за окислительно-восстановительную реакцию.
Слайд 48
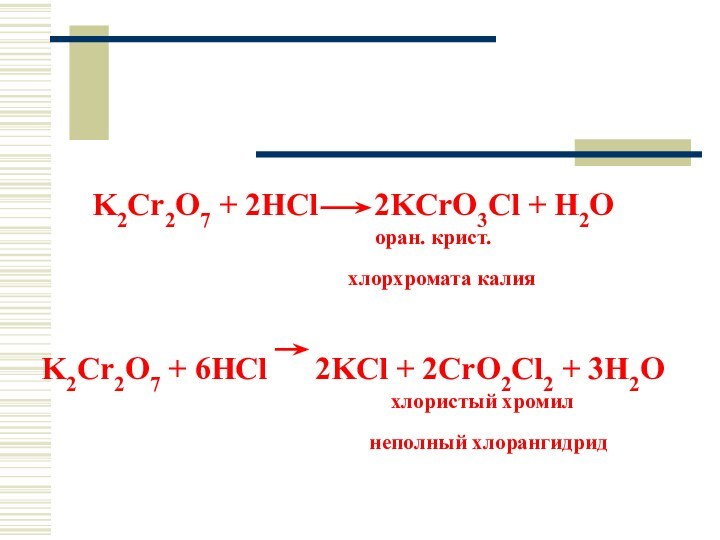
K2Cr2O7 + 2HCl 2KCrO3Cl +
H2O
оран. крист.
хлорхромата калия
K2Cr2O7 + 6HCl 2KCl + 2CrO2Cl2 + 3H2O
хлористый хромил
неполный хлорангидрид
Слайд 49
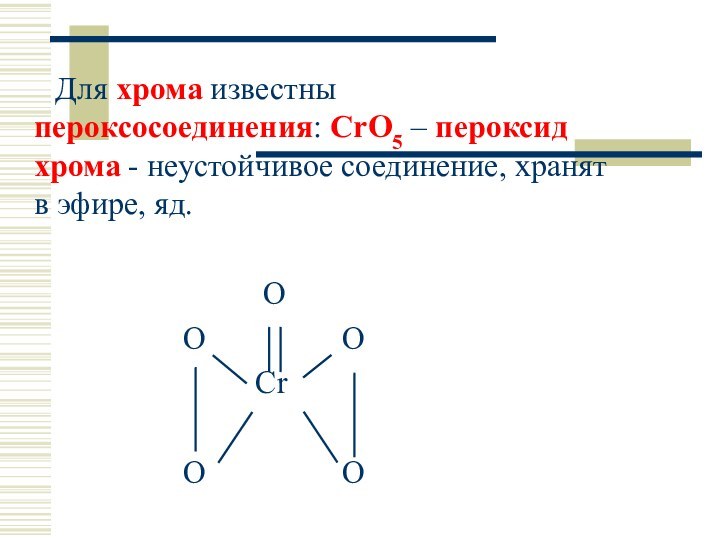
Для хрома известны пероксосоединения: CrO5 – пероксид хрома
- неустойчивое соединение, хранят в эфире, яд.
O
O O
Cr
O O
Слайд 50
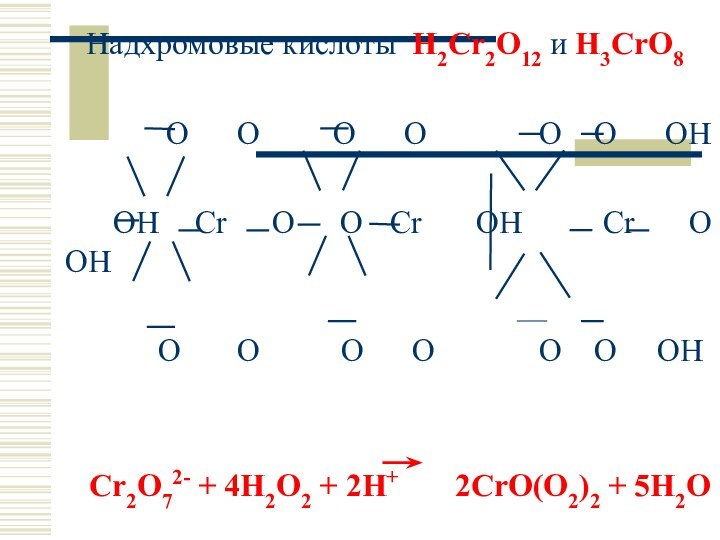
Надхромовые кислоты H2Cr2O12 и H3CrO8
O O
O O O O OH
OH Cr O O Cr OH Cr O OH
O O O O O O OH
Cr2O72- + 4H2O2 + 2H+ 2CrO(O2)2 + 5H2O
Слайд 51
CrO5 – неустойчивое соединение в воде, поэтому в
реакционную смесь добавляют диэтиловый эфир или амиловый спирт. CrO5
переходит в слой растворителя, что сильно повышает его устойчивость. Образование надхромовой кислоты является качественной реакцией на фармакопейный лекарственный препарат раствора перекиси водорода.
Слайд 52
БИОЛОГИЧЕСКАЯ РОЛЬ ХРОМА И МОЛИБДЕНА.
Слайд 53
Хром входит в состав крови, головного мозга, молока,
фермента пепсина. При его недостатке замедляется рост животных, начинается
заболевание глаз, нарушается углеводный обмен.
Слайд 54
При недостаточном поступлении его с пищей, уменьшается чувствительность
тканей к действию гормона поджелудочной железы-инсулину, ухудшаеся усвоение глюкозы,
увеличивается концентрация липидов и атеросклеротических бляшек в аорте, уменьшается оплодотворяющая способность.
Слайд 55
Хром применяется в сплавах для изготовления медицинских инструментов
– хирургических ножей, скальпелей, для изготовления зубных коронок, игл,
стерилизаторов. Дихроматы используются для получения некоторых лекарственных препаратов, например, бензойной кислоты, камфары. Дихроматометрия применяется для количественного определения лекарственных веществ, обладающих cвойствами восстановителей.
Слайд 56
Фототурбидиметрия (использование реакции взаимодействия фосфорно-вольфрамовой кислоты с аминосоединениями
с образованием дисперсной системы).
Слайд 57
Молибден жизненно необходимый элемент, входит в состав 7
ферментов (ксантиндегидрогеназа, ксантиноксидаза, альдогидроксидаза и др.)
При дефиците молибдена возникает
ксантинурия, при этом уменьшается содержание мочевой кислоты в сыворотке крови и моче. При избытке молибденоз, характеризующийся анемией, гипотонией, лейкопенией.







![Характеристика элементов VI-В группы. Хром Электронное строение Cr: […] 4s1 3d 5 4p0 Mo: […] 5s1 4d](/img/tmb/15/1403443/89f043e19137d882c8cc65137eb473fe-720x.jpg)



![Характеристика элементов VI-В группы. Хром Простые веществаCr + 2H3O+ + 4H2O → [Cr(H2O)6]2+ + H2↑Mo(W) + H3O+ ≠](/img/tmb/15/1403443/f6a395bc81781ff553a2933d9fefc0f1-720x.jpg)


![Характеристика элементов VI-В группы. Хром Пероксокомплексы Cr2O72− + 4H2O2 + 2H3O+ + L → → 2[CrVI(L)O(O22−)2] +](/img/tmb/15/1403443/888a48cfdc46246c166f52bd13a18137-720x.jpg)






![Характеристика элементов VI-В группы. Хром Cr 2+ образует аквакомплексные соединения [Cr(H2O)6]2+, в состав которых входит ион гексааквахрома](/img/tmb/15/1403443/00ce3ec9f7f79a1088e45fe22ce9bd4d-720x.jpg)


![Характеристика элементов VI-В группы. Хром Cr(OH)3 растворяется в кислотах с образованием аквакатионных комплексов [Cr(H2O)6]3+ фиолетового цвета:Cr(OH)3 +](/img/tmb/15/1403443/1fb3dec7ae060784a9ea293b1ec2b7c4-720x.jpg)
![Характеристика элементов VI-В группы. Хром Окраска комплексов связана с изомерией – гидратная изомерия хрома: [Cr(H2O)6]Cl3 – сине-фиолетовая[Cr(H2O)5Cl]H2OCl2](/img/tmb/15/1403443/b959290deb7e4c4a649f8fd6043a0cf2-720x.jpg)