- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Фосфор
Содержание
- 2. Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA) периодической системы элементов.
- 3. Фосфор занимает 12-е место по распространенности элементов
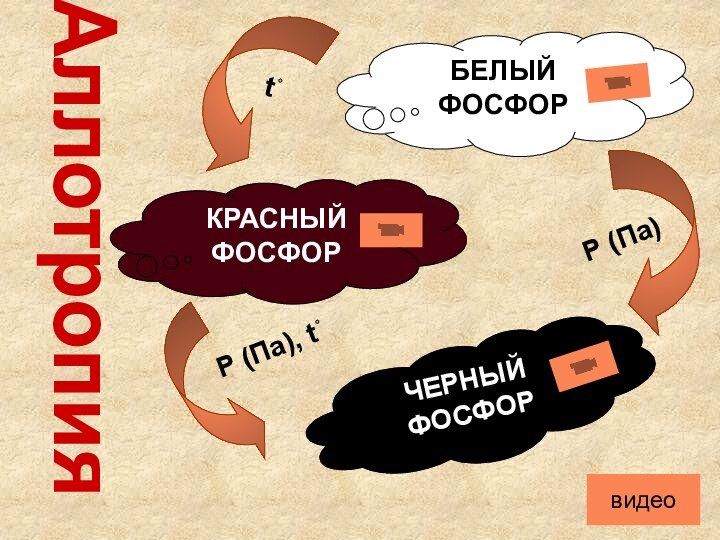
- 4. АллотропияБЕЛЫЙФОСФОРКРАСНЫЙФОСФОРЧЕРНЫЙ ФОСФОРР (Па), t˚Р (Па)t˚видео
- 5. Химические свойства
- 6. Взаимодействие с простыми веществами
- 7. Взаимодействие с металлами.
- 8. Взаимодействие с конц. азотной
- 9. Фосфор в промышленности получают из фосфата кальция
- 10. Скачать презентацию
- 11. Похожие презентации
Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA) периодической системы элементов.









Слайд 2 Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA)
периодической системы элементов.
Слайд 3 Фосфор занимает 12-е место по распространенности элементов в
природе. Он входит в состав многих горных пород и
содержится в живых организмах (в костях, зубах и т.д.).Слайд 6 Взаимодействие с простыми веществами -
неметаллами. Фосфор может реагировать со многими неметаллами: кислородом, серой,
галогенами, с водородом фосфор не реагирует. В зависимости от того, находится фосфор в избытке или недостатке, образуются соединения фосфора (III) и (V) , например: 2P + 3Br2 = 2PBr3 или 2P + 5Br2 = 2PBr5 4P + 5О2 = 2P2О5Видео
Видео
Слайд 7 Взаимодействие с металлами. При
нагревании фосфора с металлами образуются фосфиды: 3Mg + 2P
= Mg3P2 Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина PH3: Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3 Фосфин PH3 по химическим свойствам похож на аммиак NH3.Слайд 8 Взаимодействие с конц. азотной кислотой:
3Р + 5HNO3 + 2H2O = 3H3PO4 + 5NO
0
-3
+1
Р0
+ 3е → Р-3 1 ок – ль; вос – ние;Р0 - 1е → Р+1 3 вос – ль; ок – ние;
P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO2
Взаимодействие со щелочами. При нагревании белого фосфора в растворе щелочи он диспропорционирует:
Слайд 9 Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2,
который выделяют из фосфоритов и фторапатитов. Метод получения основан
на реакции восстановления Ca3(PO4)2 до фосфора. В качестве восстановителя используют кокс (углерод) . Для связывания соединений кальция добавляют кварцевый песок SiO2. Реакция протекает по уравнению: 2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + P4 +10COПолучение





























