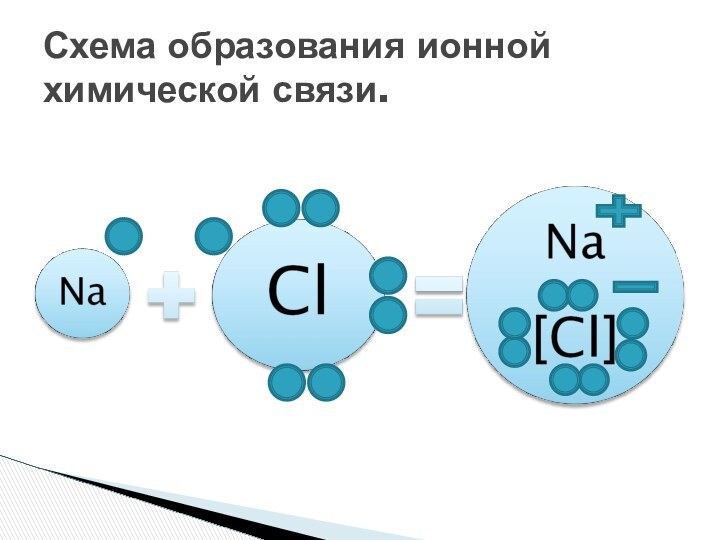
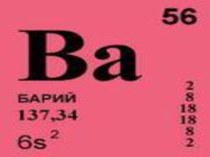вещества», на данном уроке разобрать причины и механизмы образования
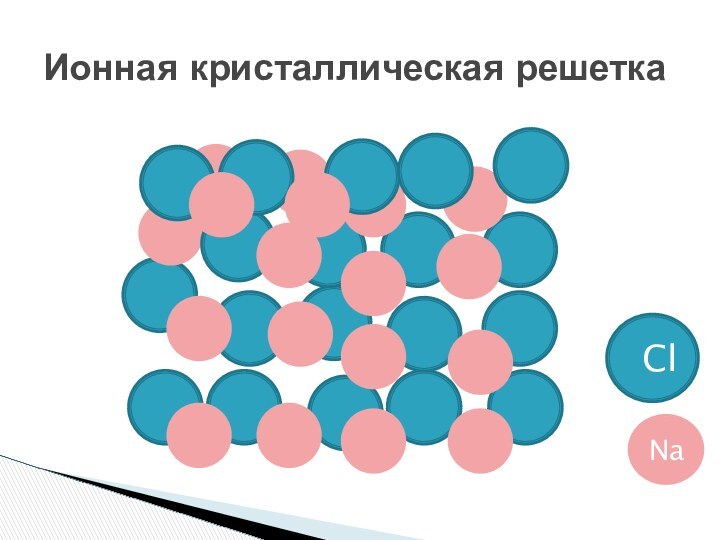
ионной связи.Познакомить: с типами ионных кристаллических решеток; с физическими свойствами веществ кристаллических решеток.
Знать основные понятия: химическая связь, ионная химическая связь, ионные кристаллические решетки.
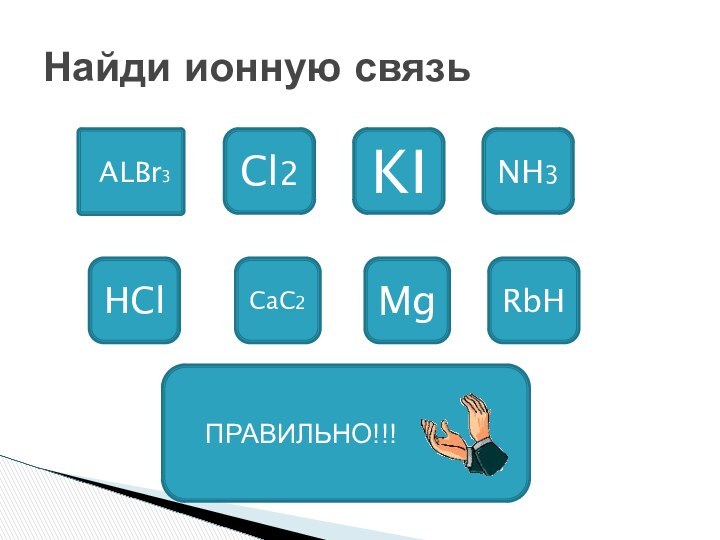
Уметь определять ионную связь.
Цель урока: сформировать понятие ионная химическая связь.