- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Химическая кинетика
Содержание
- 2. Скорость химической реакции.2. Химическое равновесие.3. Способы смещения химического равновесия.Химические реакции и закономерности их протекания.
- 3. Учение о скоростях и механизмах химических реакций
- 4. Изменение концентрации одного из
- 6. Разновидности химических процессов.Реакции, которые протекают между веществами
- 7. Скорость химических реакций.Гомогенная система
- 8. Историческая справка. Французский химик, академик.
- 9. Историческая справка.Якоб Хендрик Вант-Гофф(1852 – 1911)
- 10. Влияние на скорость химической реакции.Природа реагирующих веществПлощадь
- 11. Зависимость скорости реакции от условий её проведения.
- 12. Зависимость скорости реакции от условий её проведения.б)
- 13. Зависимость скорости реакции от условий её протекания.в) присутствия катализаторареагентыпродуктыреагентыпродуктыкатализаторэнергия активацииЭнергия активацииРегистрируется резкое увеличение скорости химической реакции.
- 14. Зависимость скорости реакции от условий её протекания.г)
- 15. Зависимость скорости реакции от условий её протекания.д)
- 16. Химические реакции, протекающие в
- 17. Обратимые химические реакции.Схема обратимого химического процесса.
- 18. Историческая справка. Анри Луи
- 20. Способы смещения химического равновесия.Изменение равновесных концентраций (концентраций
- 21. Способы смещения химического равновесия.Изменение температуры химического процесса.
- 22. Способы смещения химического равновесия.Изменение давления.Принцип Ле Шателье
- 23. https://encryptedtbn1.gstatic.com/images?q=tbn:ANd9GcTmkjq8o9PP1MPlDPUUe8J7oxxC47gLRC6m8mH5esSZLDQOjpS6 http://images./320019/slide_2.jpghttp://arhe.msk.ru/wp-content/uploads/2014/11/e2f34abf08552e65bd107600e793b75d-335x256.jpghttps://encryptedtbn3.gstatic.com/images?q=tbn:ANd9GcRFTgjEjjn4aTT9vgFkh30OFmgmlOtSLhwdpMu6vHfW_e_p2EEThttp://www.nobelpreis.org/russian/chemie/images/hoff.jpghttp://fb.ru/misc/i/gallery/10475/7254.jpghttps://encrypted-tbn0.gstatic.com/images?q=tbn:ANd9GcRCmavGqkUDFSMjZ0uWsKVrisnSYy-NRCahu_3y_MOgCXBEsskOhttp://www.varson.ru/images/Himia_jpeg_big/4-09.jpg Материалы, используемые для оформления.
- 24. Скачать презентацию
- 25. Похожие презентации


















Слайд 2
Скорость химической реакции.
2. Химическое равновесие.
3. Способы смещения химического
равновесия.
Слайд 3 Учение о скоростях и механизмах химических реакций называется
химической кинетикой.
Со скоростью химических реакций связаны представления:
О превращении веществ.
Об
экономической эффективности получения веществ в промышленных масштабах.Скорость химических процессов.
Слайд 4 Изменение концентрации одного из реагирующих
веществ в единицу времени при неизменном объеме системы называется
скоростью химической реакции.
Скорость химической реакции.
Слайд 5
По мере расходования вещества (изменения
концентрации), скорость реакции уменьшается
следовательно, скорость реакции может быть определена лишь в некий промежуток времени
средняя скорость реакции
определяется:
Уравнение определения скорости химической реакции.
моль/л · с
Слайд 6
Разновидности химических процессов.
Реакции, которые протекают между веществами в
неоднородной среде ( есть поверхность раздела между реагирующими веществами),
называютсягетерогенными.
Реакции, которые протекают в однородной среде ( нет поверхности раздела между реагирующими веществами), называются гомогенными.
Слайд 7
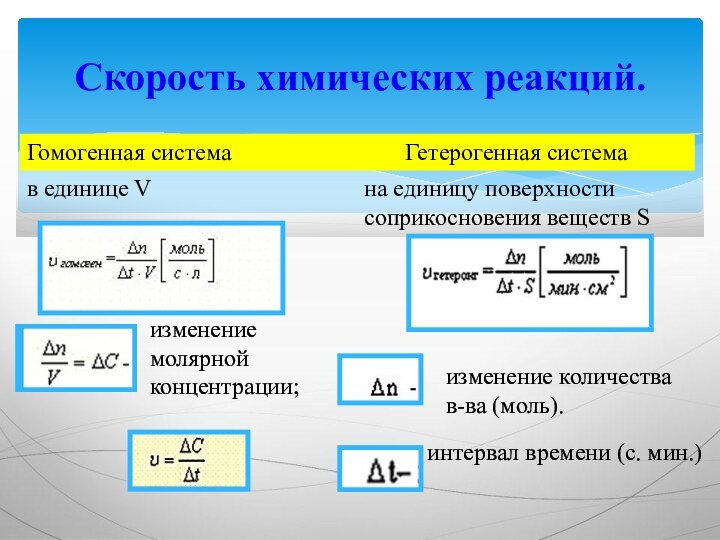
Скорость химических реакций.
Гомогенная система
Гетерогенная система
в единице V
изменение молярной концентрации;
на единицу поверхности соприкосновения веществ S
изменение количества в-ва (моль).
интервал времени (с. мин.)
Слайд 8
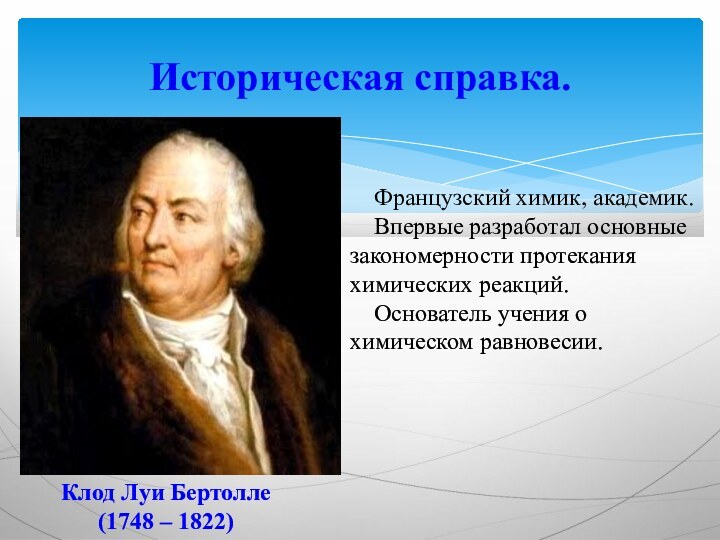
Историческая справка.
Французский химик, академик.
Впервые
разработал основные закономерности протекания химических реакций.
Основатель учения
о химическом равновесии.Клод Луи Бертолле
(1748 – 1822)
Слайд 9
Историческая справка.
Якоб Хендрик Вант-Гофф
(1852 – 1911)
Голландский химик и физик, первый лауреат Нобелевской премии по
химии (1901). Один из основателей структурной химии, химической кинетики, учения о растворах.
Слайд 10
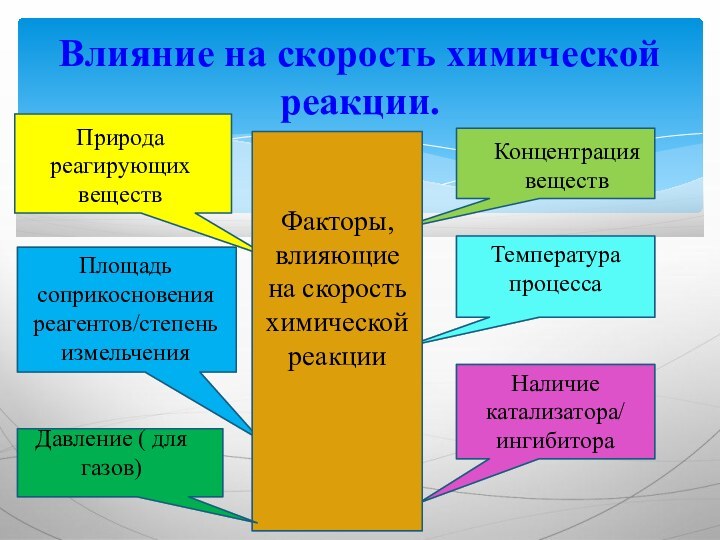
Влияние на скорость химической реакции.
Природа реагирующих веществ
Площадь соприкосновения
реагентов/степень измельчения
Концентрация веществ
Температура процесса
Наличие катализатора/
ингибитора
Факторы, влияющие на скорость химической
реакцииДавление ( для газов)
Слайд 11
Зависимость скорости реакции от условий её проведения.
Скорость
химической реакции зависит от:а) концентрации реагирующих веществ
чем выше концентрация, тем чаще молекулы или ионы будут сталкиваться, тем больше превращений веществ произойдет за единицу времени.
Слайд 12
Зависимость скорости реакции от условий её проведения.
б) от
температуры процесса
Закон Вант – Гоффа:
при повышении
температуры на каждые 10° скорость реакции увеличивается в 2 – 4 раза.
Слайд 13
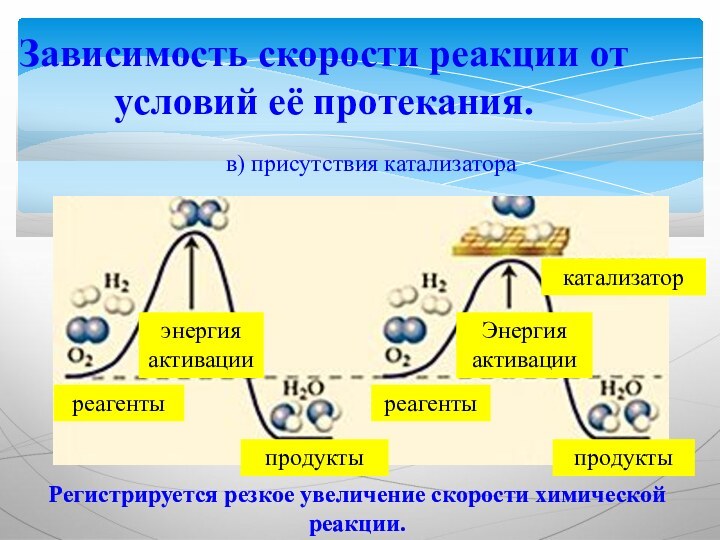
Зависимость скорости реакции от условий её протекания.
в) присутствия
катализатора
реагенты
продукты
реагенты
продукты
катализатор
энергия активации
Энергия активации
Регистрируется резкое увеличение скорости химической реакции.
Слайд 14
Зависимость скорости реакции от условий её протекания.
г) площадь
соприкосновения реагирующих веществ
чем больше площадь соприкосновения, тем выше скорость
химической реакции.мазут
воздух
Схема действия форсунки для сжигания мазута.
Слайд 15
Зависимость скорости реакции от условий её протекания.
д) природа
реагирующих веществ.
взрыв
горение
Значение энергии активации является тем фактором, посредством
которого сказывается влияние природы реагирующих веществ на скорость реакции.Слайд 16 Химические реакции, протекающие в одном
направлении, называются необратимыми.
Химические реакции, при одних
и тех же условиях протекающие и прямом и обратном направлении, называются обратимыми.Типы химических реакций ( по направлению процесса).
Слайд 18
Историческая справка.
Анри Луи Ле
Шателье
(1850 – 1936)
Занимался исследованием химического равновесия
( кинетика).
Вывел принцип смещения химического равновесия
( принцип Ле Шателье):
если находящееся в химическом равновесии система подвергается внешнему воздействию, то в ней возникают процессы, стремящиеся ослабить это воздействие.
Слайд 19
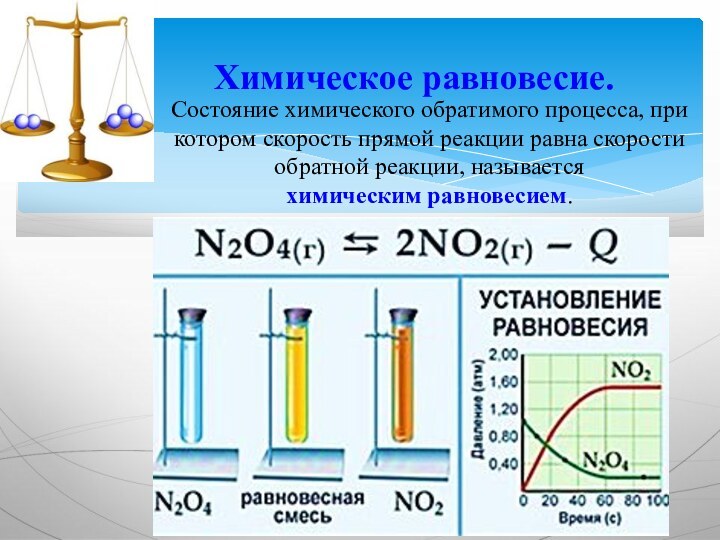
Химическое равновесие.
Состояние химического обратимого процесса, при котором
скорость прямой реакции равна скорости обратной реакции, называется химическим равновесием.
Слайд 20
Способы смещения химического равновесия.
Изменение равновесных концентраций (концентраций веществ
после установления равновесия).
Чтобы сместить равновесие в сторону образования продуктов
реакции, нужно увеличить концентрацию исходных химических веществ.Принцип Ле Шателье
Слайд 21
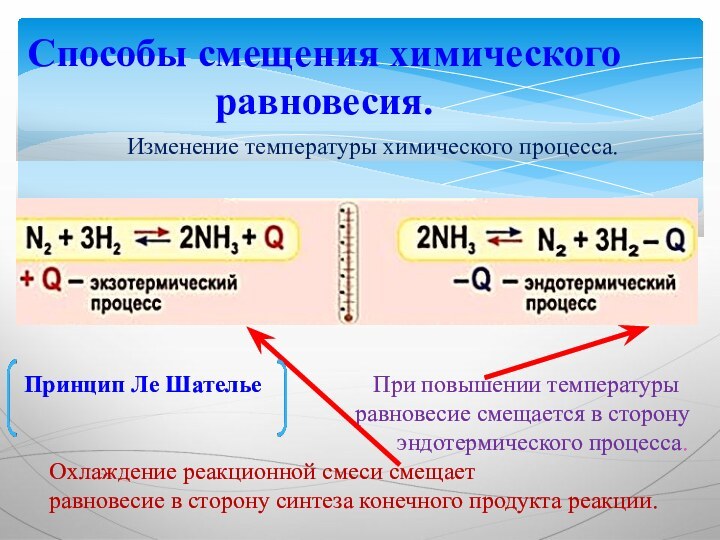
Способы смещения химического равновесия.
Изменение температуры химического процесса.
При повышении температуры
равновесие смещается в сторону
эндотермического процесса.
Охлаждение реакционной смеси смещает
равновесие в сторону синтеза конечного продукта реакции.
Принцип Ле Шателье