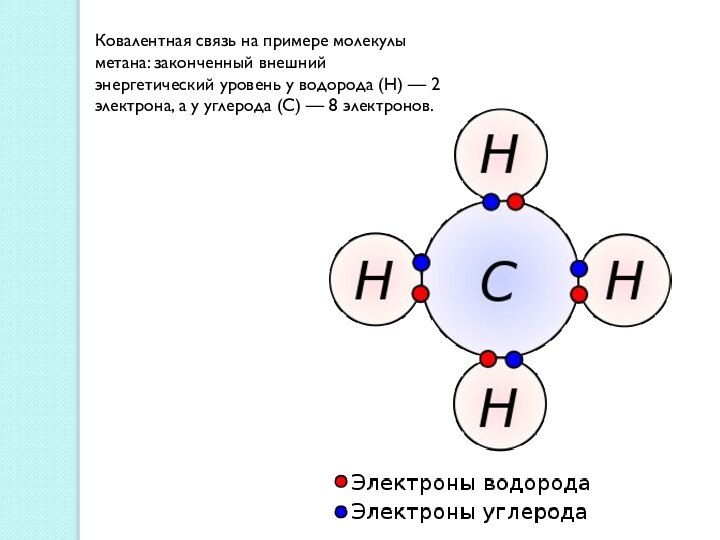
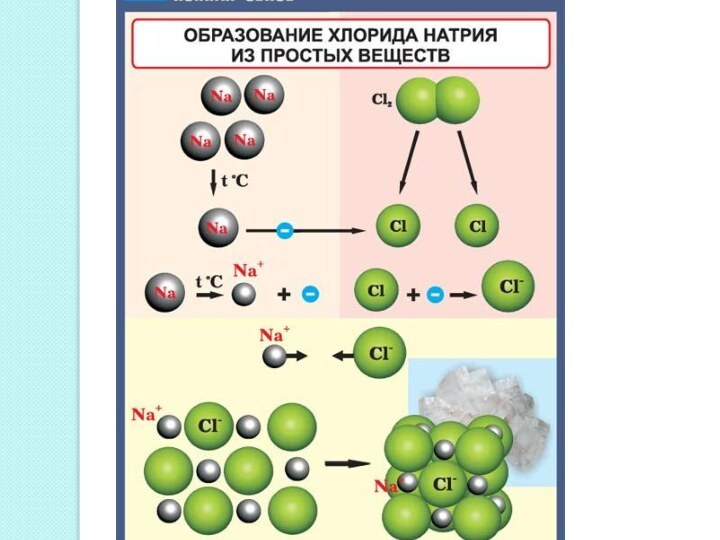
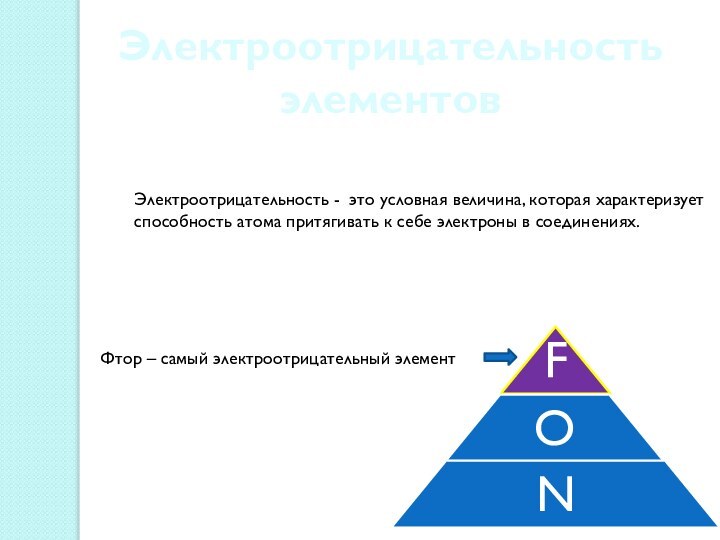
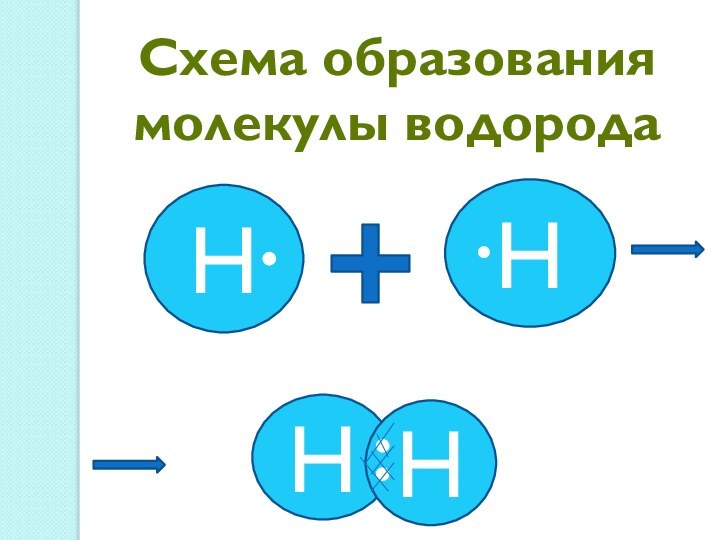
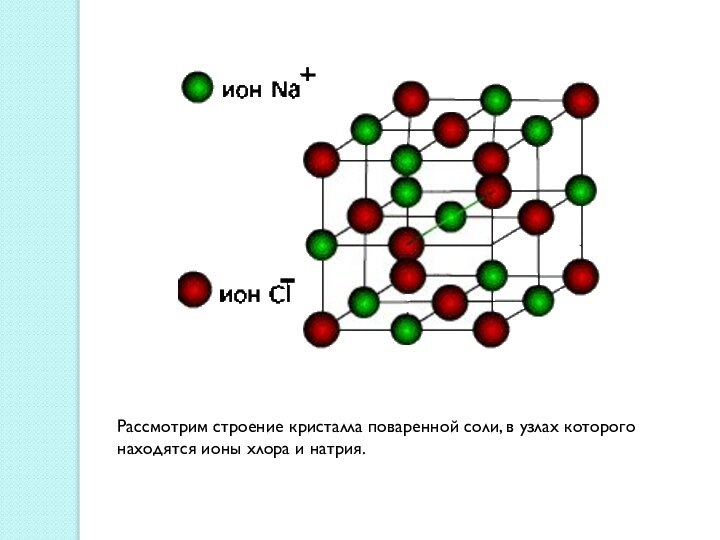
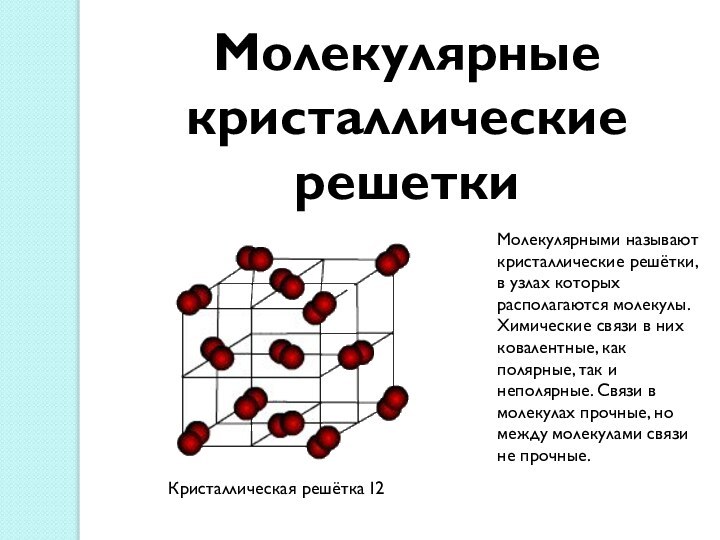
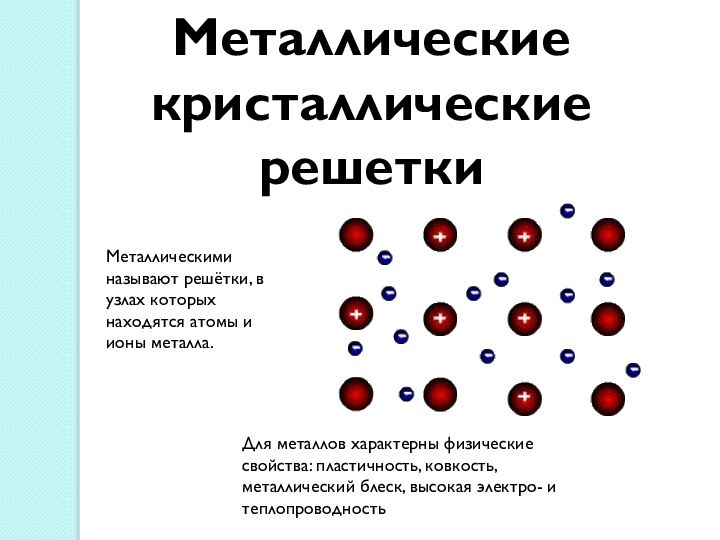
между атомами, обеспечивающая существование веществ с четко определенным составом.
При образовании ковалентной химической связи важную роль в уменьшении полной энергии играет обменное взаимодействие.Ковалентная связь
Ионная связь
Виды химической связи: