Слайд 3
Повторить:
1)Определение понятий: кислоты, электролиты, неэлектролиты, электролитическая диссоциация
2) Механизм электролитической диссоциации веществ
Закрепить умения:
1) Составлять уравнения
ЭД кислот
2) Пользоваться таблицей растворимости
3) Составлять уравнения реакций ионного обмена
4) Проводить реакции ионного обмена, подтверждающие химические свойства кислот, соблюдая правила безопасного обращения с реактивами, и выявлять признаки наблюдаемых химических реакций
Изучить:
1)Классификацию кислот
2) Химические свойства кислот с точки зрения ТЭД
Слайд 12
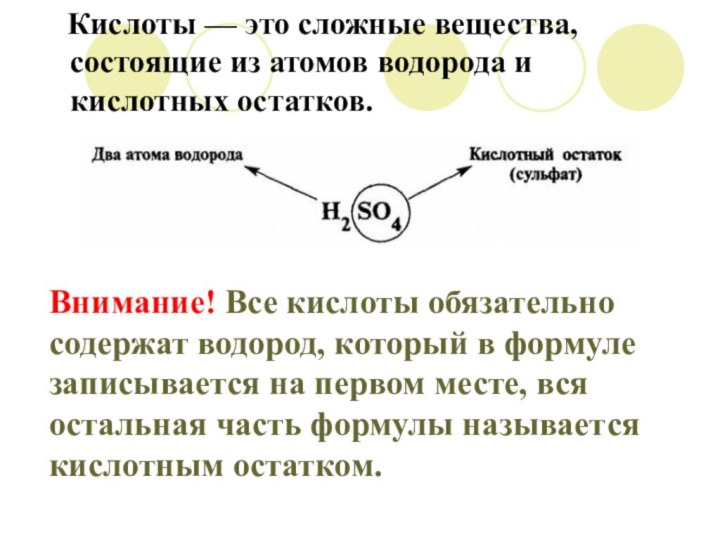
Внимание! Все кислоты обязательно содержат водород, который в
формуле записывается на первом месте, вся остальная часть формулы
называется кислотным остатком.
Кислоты — это сложные вещества, состоящие из атомов водорода и кислотных остатков.
Слайд 13
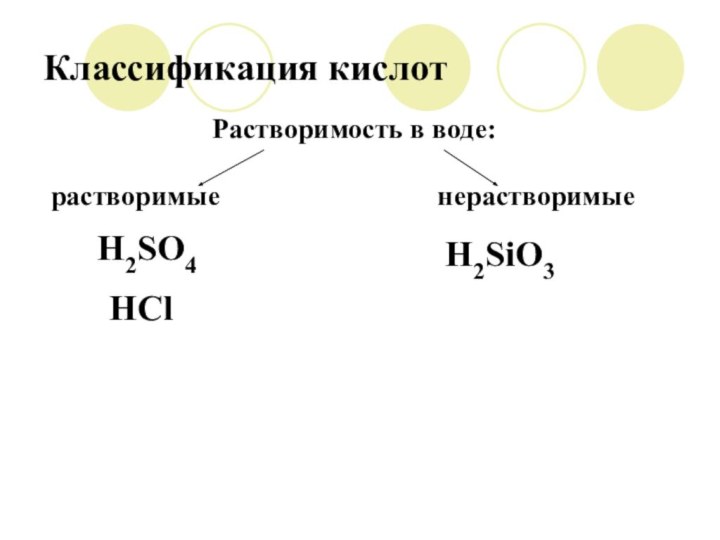
Классификация кислот
Растворимость в воде:
растворимые
нерастворимые
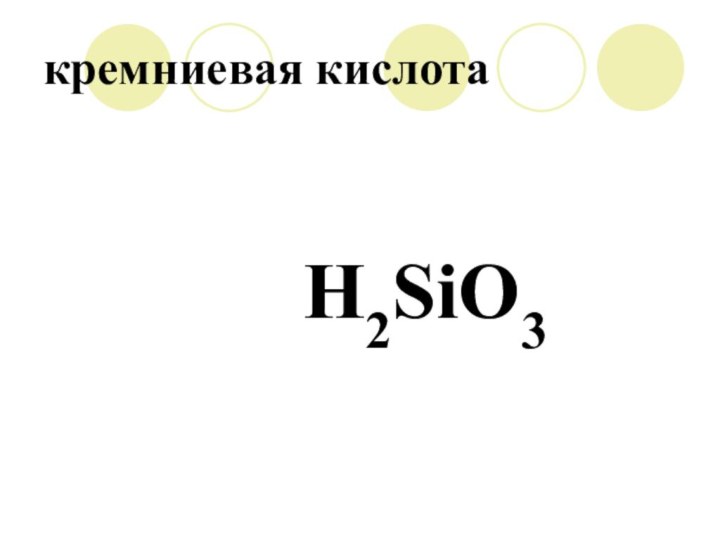
H2SiO3
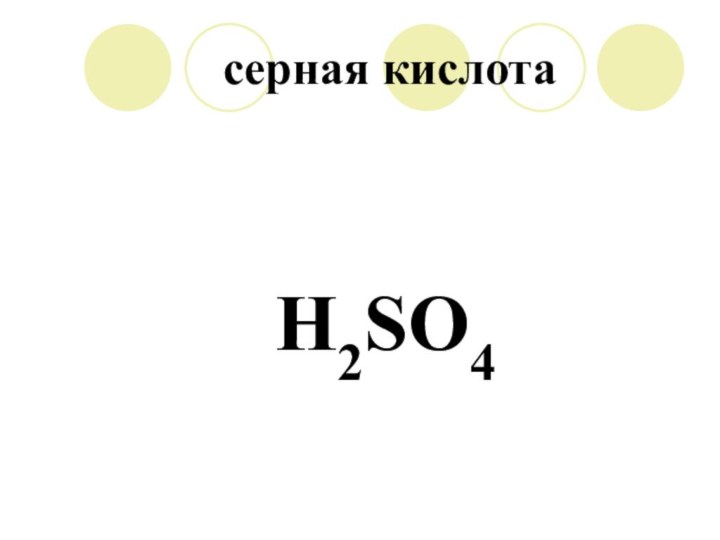
H2SO4
HCl
Слайд 14
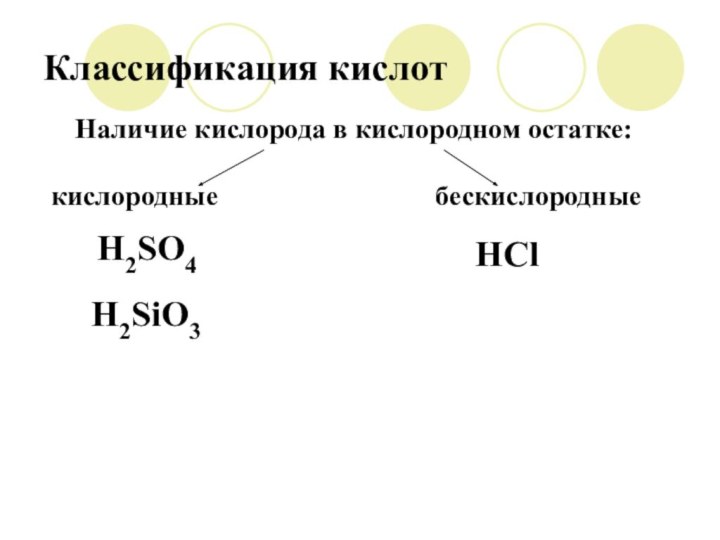
Классификация кислот
Наличие кислорода в кислородном остатке:
кислородные
бескислородные
H2SiO3
H2SO4
HCl
Слайд 15
Классификация кислот
Основность:
а) одноосновные HCl, HNO3
б) двухосновные
H2S, H2SO4
в) трехосновные H3PO4
Слайд 17
Кислоты – это электролиты, при диссоциации которых образуются
катионы водорода и анионы кислотного остатка.
Слайд 18
Кислота, когда здорова,
Угостить друзей готова
Тем, что ей
дала природа, -
Катионом водорода
Н+
Слайд 19
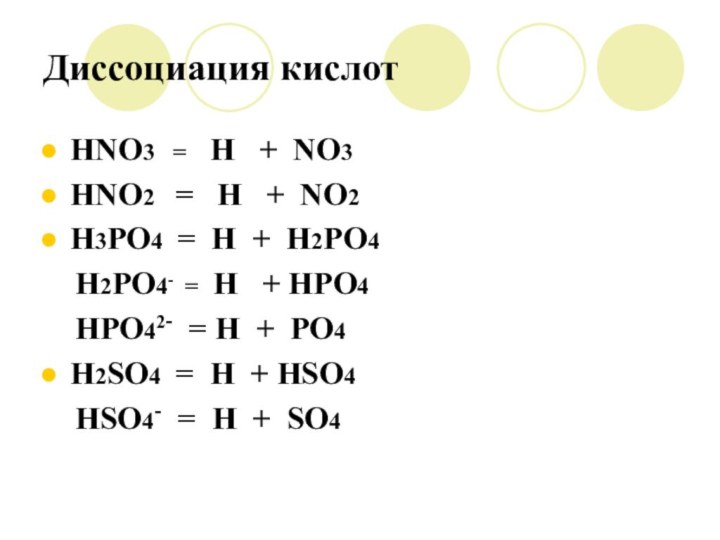
Диссоциация кислот
HNO3 = H +
NO3
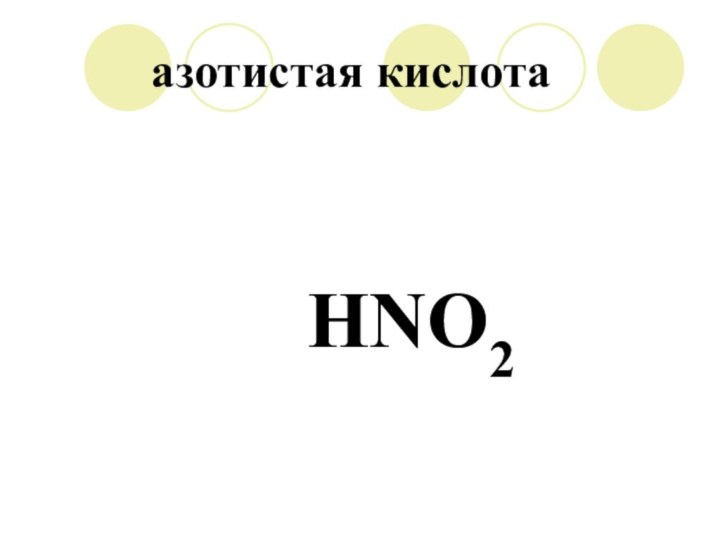
HNO2 = H + NO2
H3PO4 =
H + H2PO4
H2PO4- = H + HPO4
HPO42- = H + PO4
H2SO4 = H + HSO4
HSO4- = H + SO4
Слайд 20
Диссоциация кислот:
HNO3 = H +
NO3
HNO2 = H + NO2
H3PO4 =
H + H2PO4
H2PO4- = H + HPO4
HPO42- = H + PO4
H2SO4 = H + HSO4
HSO4- = H + SO4
+
+
+
+
+
+
+
3-
-
-
2-
-
-
2-
Слайд 23
Запомни! Сначала - вода,
Потом – кислота,
Иначе случится беда!
Слайд 24
Химические свойства:
а) с индикаторами;
Слайд 28
Химические свойства:
с металлами, стоящими в электрохимическом
ряду напряжений до водорода
K, Ca, Na, Mg, Al,
Zn, Fe, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au
Кислота + металл = соль + водород
Слайд 29
Химические свойства:
с основными оксидами
Оксид металла + кислота
=
соль + вода
Слайд 30
Химические свойства:
с основаниями с образованием соли
и воды
Основание + кислота =
соль + вода
Слайд 31
Химические свойства
с солями более летучих или
слабых кислот
Соль + кислота =
новая соль + новая
кислота
Слайд 32
Химические свойства:
Кислота
+ соль = новая соль +
новая кислота
+ основание = соль + вода
+ оксид металла
= соль +вода
+ металл = соль + водород
Слайд 33
Кислота, когда здорова,
Угостить друзей готова
Тем, что ей
дала природа, -
Катионом водорода
Н+
Вариант 2
1) Выбрать вещества, с которыми реагирует:
HCl H2SO4
а) H2O, KOH, MgO а) Al, Na2S, Cu(OH)2
б) Mg, NaOH, CaCO3 б) K2SO4, H2O, NaOH
в) KOH, H2S, P г) HNO3, ZnO, CO2
2) Выбрать оксиды, с которыми реагирует:
H2SO4 HCl
а) CaO, Al2O3 а) SO2, H2O
б) CO2, P2O5 б) ZnO, CO2
в)MgO, N2O5 в) BaO, Fe2O3
Слайд 35
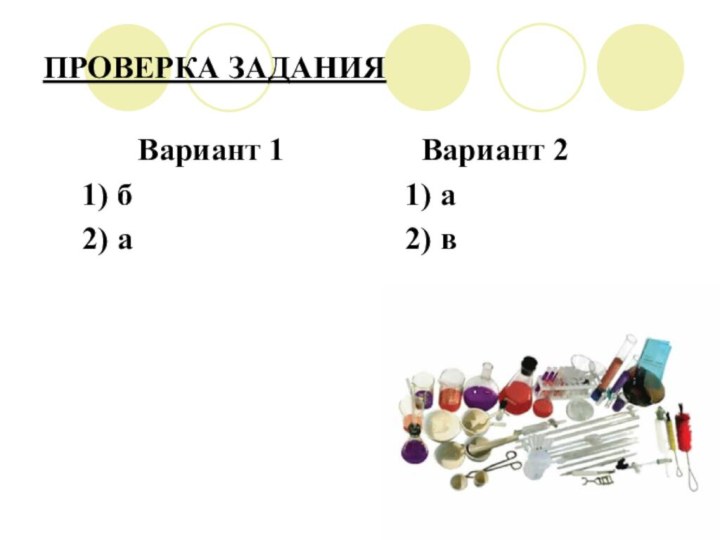
ПРОВЕРКА ЗАДАНИЯ
Вариант 1
Вариант 2
1) б 1) а
2) а 2) в
Слайд 36
Повторить:
1)Определение понятий: кислоты, электролиты, неэлектролиты, электролитическая диссоциация
2) Механизм электролитической диссоциации веществ
Закрепить умения:
1) Составлять уравнения
ЭД кислот
2) Пользоваться таблицей растворимости
3) Составлять уравнения реакций ионного обмена
4) Проводить реакции ионного обмена, подтверждающие химические свойства кислот, соблюдая правила безопасного обращения с реактивами и выявлять признаки наблюдаемых химических реакций
Изучить:
1)Классификацию кислот
2) Химические свойства кислот с точки зрения ТЭД