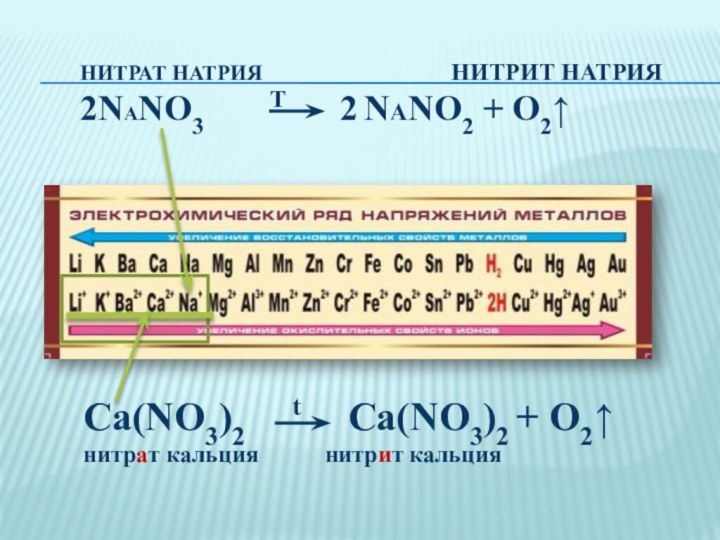
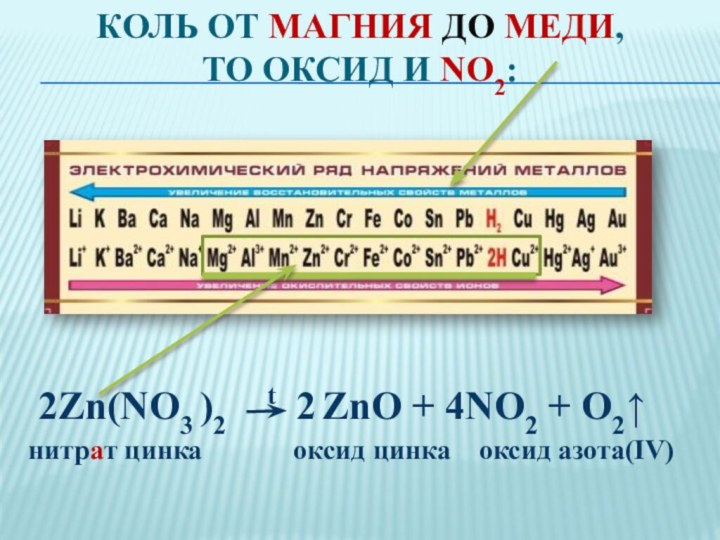
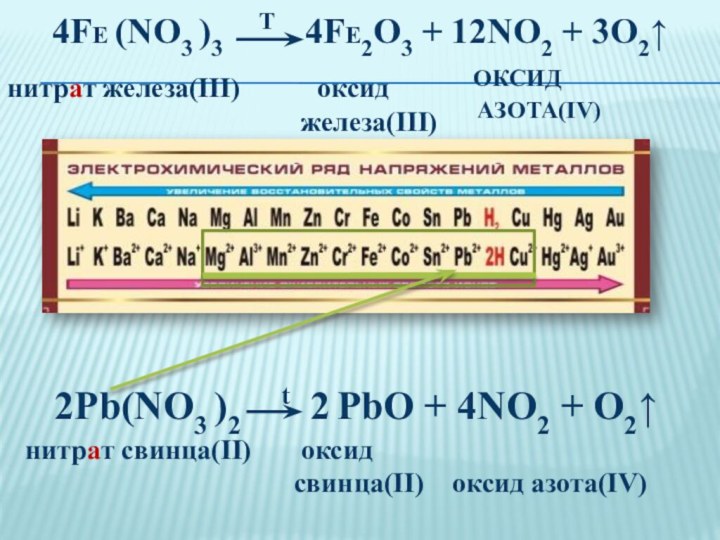
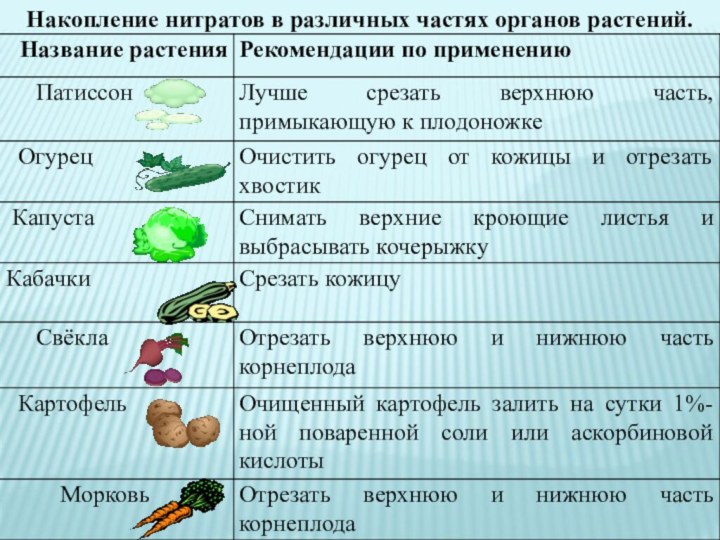
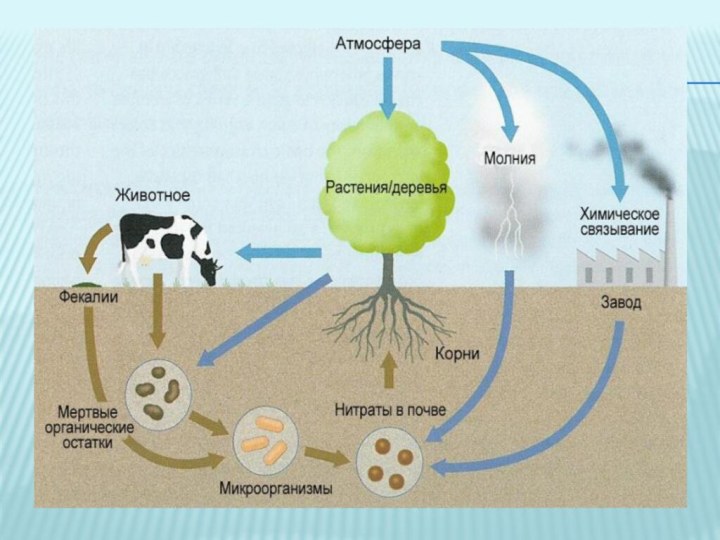
Это вещество в Европе называют
«китайским снегом» ; в 808 году китайский алхимик Цинь на его основе изобрел дымный порох .Определите молекулярную формулу вещества , если в его состав входит 38,61 % калия , 13,86 % азота и кислород .