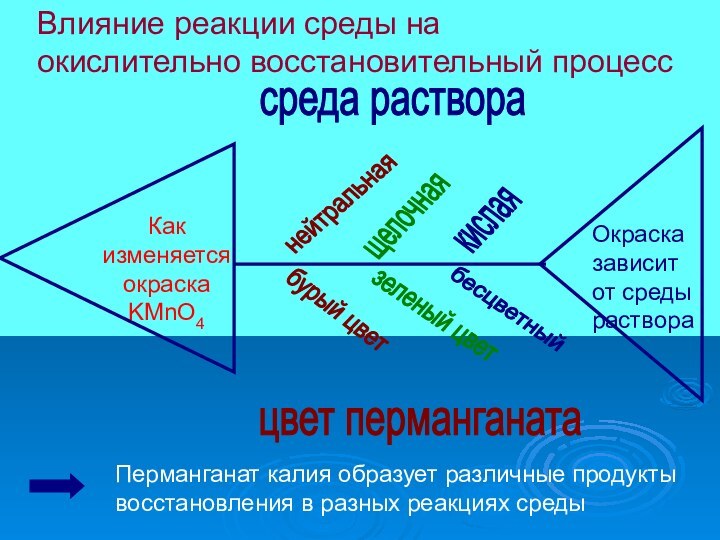
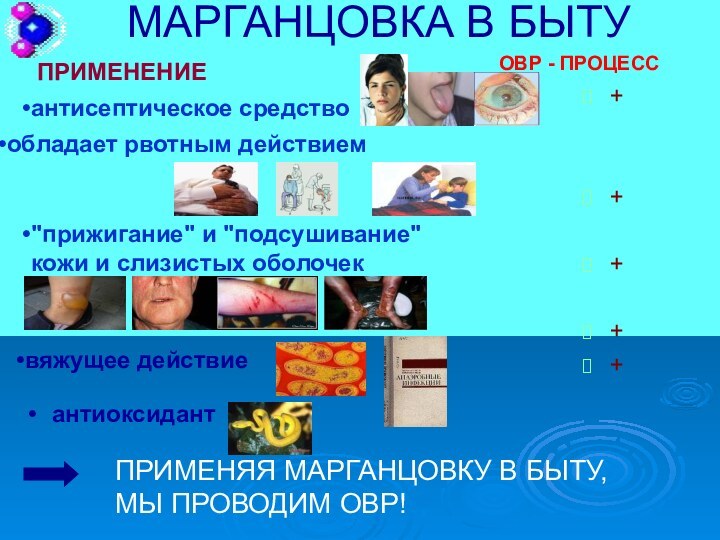
практические исследования влияния условий реакции на окислительное – восстановительные
свойства веществВыяснить значение одного из таких веществ в быту с точки зрения ОВР
Цель: ВЫЯВЛЕНИЕ ВЕЩЕСТВА, КОТОРОЕ МОЖЕТ МЕНЯТЬ ЦВЕТ В ВИСИМОСТИ ОТ СИТУАЦИИ, изучение его свойств и применения