Слайд 2
Что читать?
Карапетьянц М. Х., Дракин С. И. Общая
и неорганическая химия.
Ахметов Н. С. Общая и неорганическая
химия.
Чупахин А. П. Химический процесс: энергетика и равновесие.
Глинка Н.Л. Общая химия.
Слайд 3
Список сокращений и основных обозначений
Выучить!
Чупахин А. П. Химический процесс:
энергетика и равновесие .
Стр. 5 -7.
Слайд 4
Примеры обозначений
H - энтальпия
A - работа
с - теплоемкость
ср
- изобарная теплоемкость
C - концентрация
U - внутренняя энергия
Q -
тепло
Na – число Авгадро
R – универсальная газовая постаянная
Слайд 5
Изучили:
Будем изучать:
Строение вещества
Статистическое состояние
Процесс
Движение
Слайд 6
Наука о движении в химии делится на две
части
Термодинамика
Кинетика
1. Куда будет двигаться система?
2. Где конечная остановка?
3. Сколько
энергии выделится или
затратится за время пути?
1. Как быстро будет двигаться?
2. Какими путем будет двигаться?
Каждая отвечает на вопросы:
Стратегия
Тактика
Слайд 7
Термодинамика
Отдел физики, изучающий теплоту и закономерности теплового движения.
Николя́
Леона́р Сади́ Карно́
Nicolas Léonard Sadi Carnot
Джеймс Прескотт Джоуль
James Prescott
Joule
dU = δQ – δW
Первое начало термодинамики
Слайд 8
Химическая термодинамика
рассматривает взаимосвязи между работой и энергией применительно
к химическим превращениям.
Слайд 10
Система
Совокупность тел, энергетически взаимодействующих между собой и с
другими телами, обменивающихся с ними веществом
Обмен с окружающей средой
Слайд 11
Система
Гомогенные Гетерогенные
Однородные Не однородные
Слайд 12
Процессы
Изотермические (T =const)
Изохорические (V =const)
Изобарические (P =const)
Адиабатические (Q
=const) Изолированная система
Слайд 13
Процессы
Обратимые процессы – процессы, в которых система возвращается в
первоначальное состояние.
Необратимые – когда система не возвращается в первоначальное состояние.
Слайд 14
Процессы
Самопроизвольными называют такие процессы, которые протекают без внешнего
воздействия, при постоянстве всех внешних условий.
Равновесные процессы – такие
обратимые процессы, при которых исходное, конечное и все промежуточные состояния должны быть равновесными и мало отличающимися друг от друга
Слайд 15
Функции
Функции могут зависеть от пути процесса. Функции, которые
зависят от начального и конечного состояний системы и не
зависят от пути процесса, – функции состояния; внутренняя энергия U, энтальпия H , энтропия S и другие – полные дифференциалы.
Функции, которые зависят от начального и конечного состояний системы и зависят от пути процесса, не являются функциями состояния и не являются полными дифференциалами Q, A.
Слайд 16
Экстенсивные и интенсивные функции
Экстенсивное свойство системы прямо пропорционально массе системы
и обладает аддитивностью (можно складывать): V, H, Uвн, S, G, F.
Интенсивное свойство системы не зависит от
массы системы и не обладает свойством аддитивности: Q, A, T, P.
Давление – параметр состояния, определяемый силой, действующей в теле на единицу площади поверхности по нормали к ней. Оно характеризует взаимодействие системы с внешней средой.
Температура определяет меру интенсивности теплового движения молекул.
Слайд 17
Химический процесс
Процесс с изменением химического состояния веществ.
Разрыв
и образование химических связей.
Слайд 18
Стехиометрическое уравнение
ΣаiАi = ΣbiBi
2SO2(газ) + O2(газ) = 2SO3(газ
или
ΣyiYi = 0,
2SO3(газ) – 2SO2(газ) – O2(газ) = 0.
Слайд 19
Стехиометрическое уравнение ХП отражает фундаментальные законы природы –
сохранение массы и заряда. (Закон Ломоносова–Лавуазье)
2SO2(газ) + O2(газ) = 2SO3(газ),
2MnO4– + 10Cl– + 16H+ = 2Mn2+ + 5Cl2 + 8H2O
Материальный и зарядовый баланс
Слайд 20
Энергия
Энергия – форма существования материи. Мера движения и
взаимодействия материи.
Кинетическая и потенциальная.
Потенциалы:
Гравитационный
Электромагнитный
Ядерный
Химический
Слайд 21
Энергия системы
Тепловое движение
Энергия химических и межмолекулярных связей (электромагнитное
взаимодействие)
Фактор упорядочения
Концентрации частиц
Слайд 22
Тепловая энергия
RТ в расчёте на моль – kТ
на молекулу
R = NA · k
R = 8,31 Дж/(моль ·К) – универсальная газовая
постоянная
k = 1,38 ·10-23 Дж/(моль ·К) – константа Больцмана
NA = 6,02 ·1023 шт/моль – число Авагадро
Слайд 23
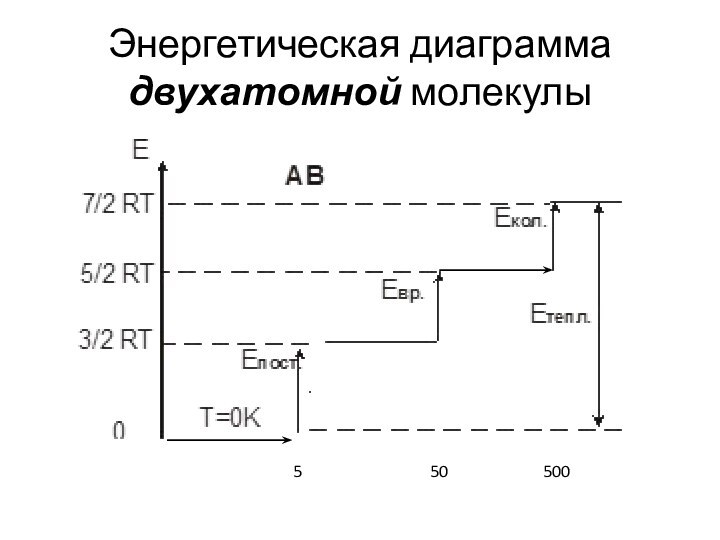
Энергетическая диаграмма двухатомной молекулы
5
50
500
Слайд 24
Шкала температуры
В Термодинамике только Кельвины!
Слайд 25
Теплоемкость
Теплоёмкость с – это количество теплоты δQ, поглощаемой
телом при его нагревании на dТ, т. е. производная теплоты по
температуре с = δQ / dТ.
Для одноатомных газов молярная теплоёмкость cV = (dEтепл. / dT) = = (3 / 2)R = 12,5 Дж / К · моль.
Для двухатомных молекул в зависимости от Т теплоёмкость увеличивается от (3 / 2)R через (5 / 2)R = 20,8 Дж / К · моль до (7 / 2)R ≈ 29,1 Дж / К · моль (с ростом Т).
для четырёхатомной молекулы аммиака сV изменяется от 3R = 24,9 (от 50 до 500 К) до 9R = 74,8 Дж / К · моль (свыше 500 К).
Слайд 26
Энергия химических связей
Химический процесс – разрыв и образование
химических связей.
Энергия 1 моля хим. связи около 300000 Дж.
Энергия
затрачиваемая на нагрев 1 моля газа на 100 К около 3000 Дж ( в 100 раз меньше).
при не слишком высоких температурах энергия химических связей на порядки превышает тепловую.
При высоких температурах, когда тепловая энергия и энергия связей сравнивается молекулы разрушаются на атомы.
Слайд 27
Диссоциация двухатомной молекулы
H2 = H + H 435,9
O2 =
O + O 498,7
N2 = N + N 945,6
I2 = I
+ I 151,0
HI = H + I 298,4 D298, кДж/моль
УМК, стр. 72.
Слайд 28
Образование иодоводорода из простых веществ
H2 + I2 =
2HI
Нужно разорвать две связи H—H и I—I.
Образовать две связи
H—I.
ΔE = D(H2) + D(I2) - 2D(HI)
затрачиваем (+) выделяется (-)
ΔE = 435,9 + 151,0 - 2 x 298,4
ΔE = -9,9 кДж/моль
Слайд 29
Образование иодоводорода из простых веществ
ΔE = -9,9 кДж/моль
Отрицательное
значение - энергия выделяется. Экзотермичная реакция.
Положительное значение - энергия
поглощается. Эндотермичная реакция.
Энергия реакция сравнима с тепловой энергией. Иодоводород будет распадаться при T = ΔE/сv ≈ 330 K
Слайд 30
Энергетическая диаграмма
H2 + I2
2HI
H2 + I + I
H
+ H + I + I
D(H2)
D(I2)
2D(HI)
E
ΔE
Слайд 31
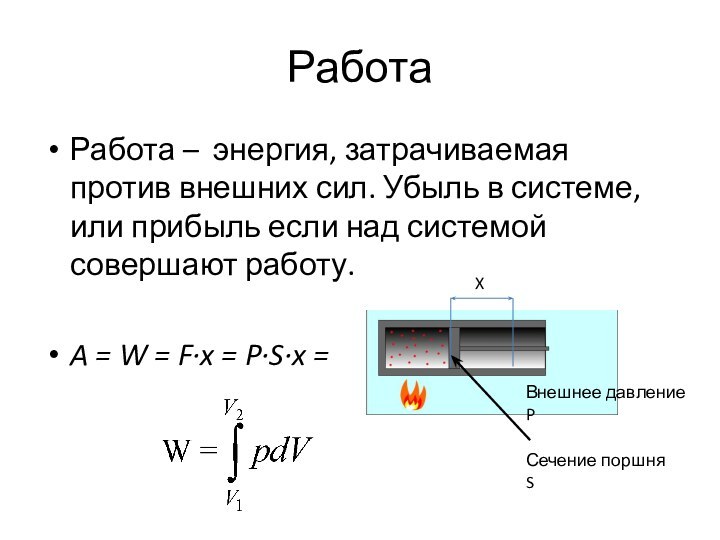
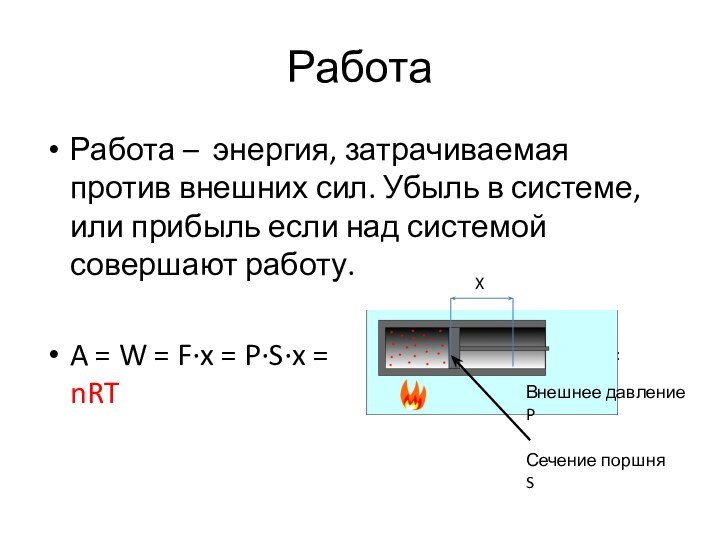
Работа
Работа – энергия, затрачиваемая против внешних сил. Убыль
в системе, или прибыль если над системой совершают работу.
A
= W = F·x = P·S·x = = P·ΔV
X
Сечение поршня S
Внешнее давление P
Слайд 32
1 начало термодинамики
ΔU = Q – W,
dU = δQ – δW
Закон сохранения энергии
Слайд 33
Изменение теплоты при изохорном процессе
ΔQv = ΔU +
W
Так как ΔV = 0, P·ΔV = 0,
и W = 0!
ΔQv = ΔU
cv = δQ / dТ = dU/dT (3/2R, 5/2R и.т.д.)
Слайд 34
PV = nRT
Закон Ломоносова-Клапейрона
Размерность PV и nRT –
Джоуль.
К этому уравнению вернемся позже.
Слайд 35
Работа
Работа – энергия, затрачиваемая против внешних сил. Убыль
в системе, или прибыль если над системой совершают работу.
A
= W = F·x = P·S·x = = P·ΔV = nRT
X
Сечение поршня S
Внешнее давление P
Слайд 36
Изменение теплоты при изохорном процессе
ΔQp = ΔU +
W
W = PΔV = RT
ΔQp = ΔU +
RT = ΔH – энтальпия
cp = δQ / dТ = dH/dT = dU/dT + RdT/dT = Cv + R
Слайд 37
Энтальпия
H
Энтальпи́я — термодинамический потенциал, характеризующий состояние системы
в термодинамическом равновесии при выборе в качестве независимых переменных
(не меняются) давления, энтропии и числа частиц.
Изобарно-изоэнтропийный потенциал.
Тепловой эффект изобарных химических процессов.
Слайд 38
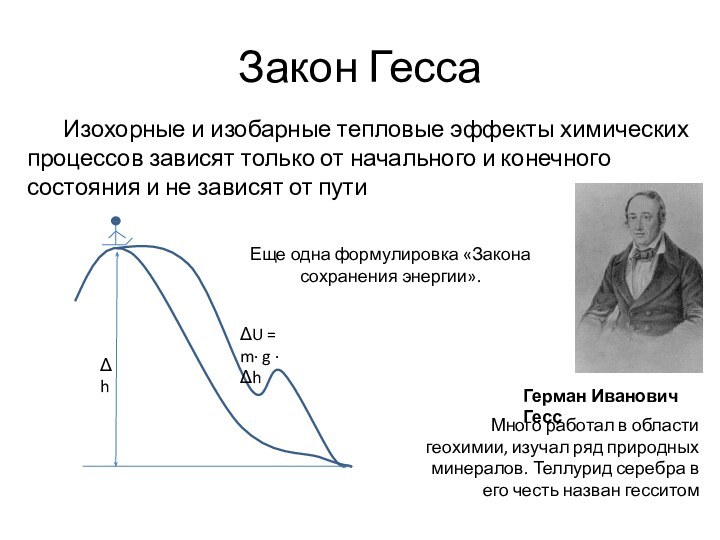
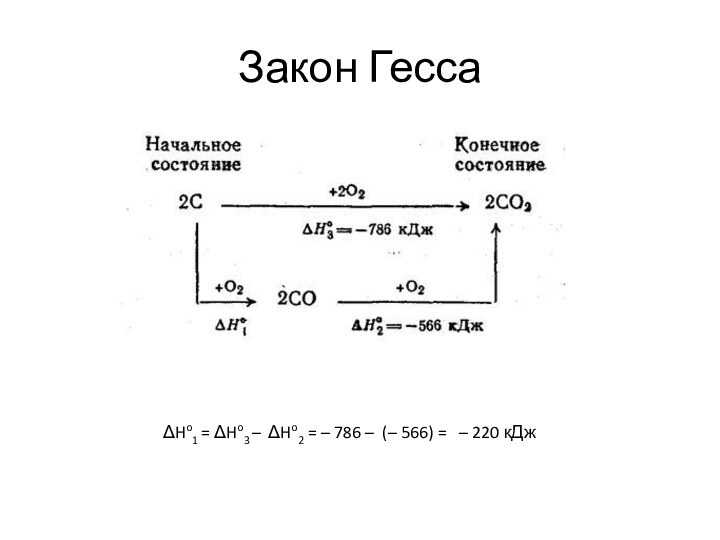
Закон Гесса
Герман Иванович Гесс
Много работал в области геохимии,
изучал ряд природных минералов. Теллурид серебра в его честь
назван гесситом
Изохорные и изобарные тепловые эффекты химических процессов зависят только от начального и конечного состояния и не зависят от пути
Еще одна формулировка «Закона сохранения энергии».