- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Аммиак
Содержание
- 2. Аммиак (в европейских языках его название звучит
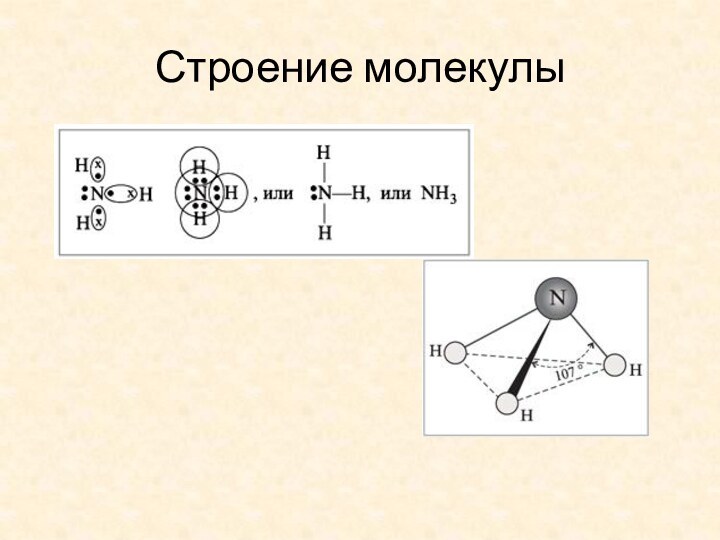
- 3. Строение молекулы
- 4. Получение промышленный способ Промышленный способ получения аммиака
- 5. Производство аммиакаКолонна синтеза аммиака: 1-люк для выгрузки
- 6. В лабораторииДля получения аммиака в лаборатории используют
- 7. Химические свойства1. Горение аммиака (при нагревании)4NH3 +
- 8. с оксидами металлов2 NH3 + 3CuO =
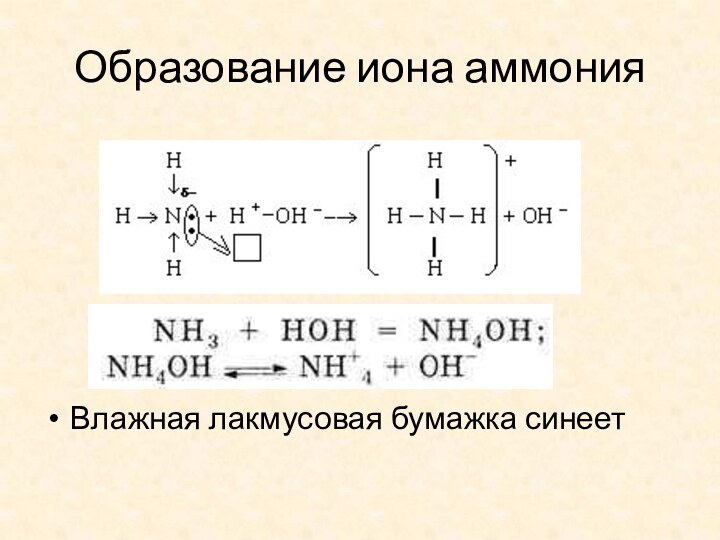
- 9. Образование иона аммонияВлажная лакмусовая бумажка синеет
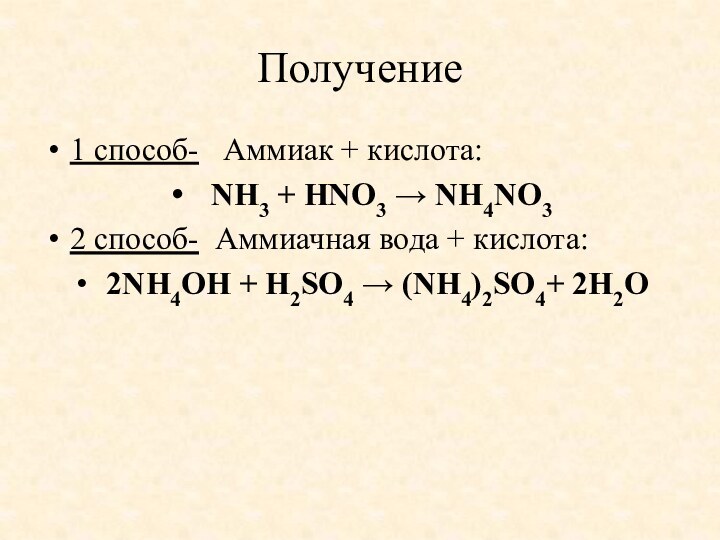
- 10. Получение1 способ- Аммиак + кислота: NH3 +
- 11. Соли аммонияNH4Cl – хлорид аммония(NH4)2SO4 - сульфат
- 12. Скачать презентацию
- 13. Похожие презентации
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке караванных путей. В жарком климате мочевина (NH2)2CO, содержащаяся в продуктах жизнедеятельности животных, разлагается особенно быстро. Одним







Слайд 4
Получение промышленный способ
Промышленный способ получения аммиака основан
на прямом взаимодействии водорода и азота:
N2(г) + 3H2(г) ↔
2NH3(г) + 45,9 кДжУсловия:
катализатор – пористое железо
температура – 450 – 500 ˚С
давление – 25 – 30 МПа
Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода).
Слайд 5
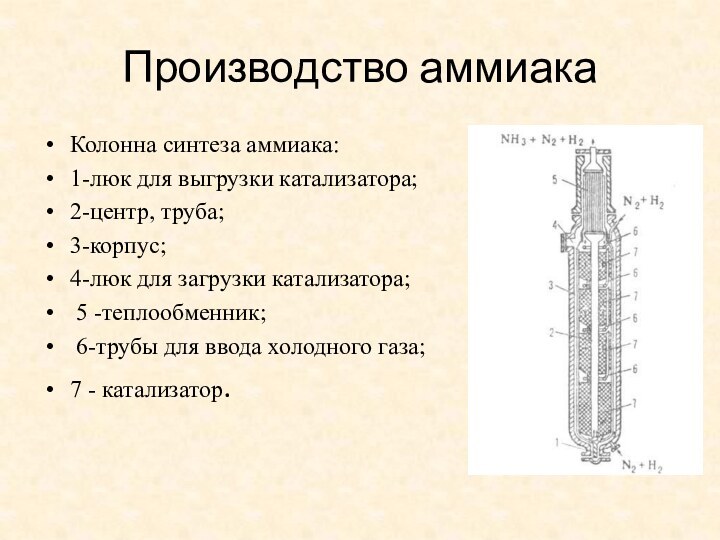
Производство аммиака
Колонна синтеза аммиака:
1-люк для выгрузки катализатора;
2-центр, труба;
3-корпус;
4-люк для загрузки катализатора;
5 -теплообменник;
6-трубы для ввода холодного газа; 7 - катализатор.
Слайд 6
В лаборатории
Для получения аммиака в лаборатории используют действие
сильных щелочей на соли аммония:
NH4Cl + NaOH = NH3↑
+ NaCl + H2O(NH4)2SO4 + Ca(OH)2 = 2NH3↑ + CaSO4 + 2H2O
Внимание! Гидроксид аммония неустойчивое основание, разлагается: NH4OH ↔ NH3↑ + H2O
При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха:
Слайд 7
Химические свойства
1. Горение аммиака (при нагревании)
4NH3 + 3O2
→ 2N2 + 6H20
2. Каталитическое окисление амииака (катализатор Pt
– Rh, температура)4NH3 + 5O2 → 4NO + 6H2O
Слайд 8
с оксидами металлов
2 NH3 + 3CuO = 3Cu
+ N2 + 3 H2O
С окислителями
2NH3 + 3Cl2 =
N2 + 6HCl (при нагревании)аммиак – непрочное соединение, при нагревании разлагается
2NH3↔ N2 + 3H2