класса углеводородов.
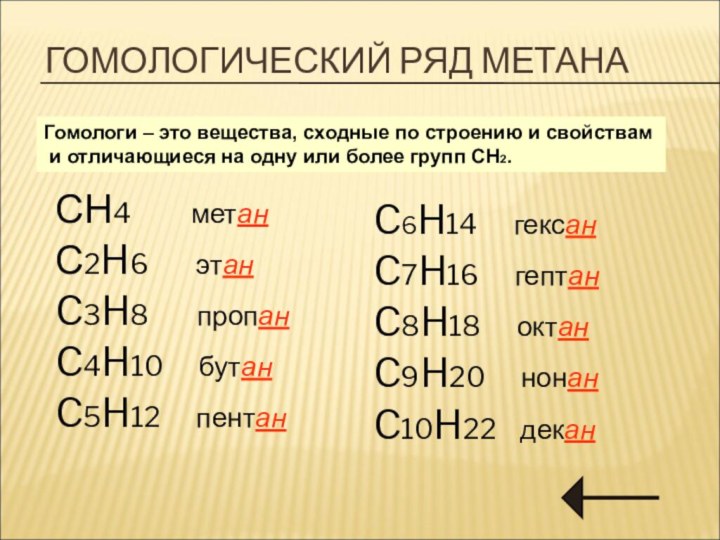
Гомологический рядряд.
Виды изомерии.
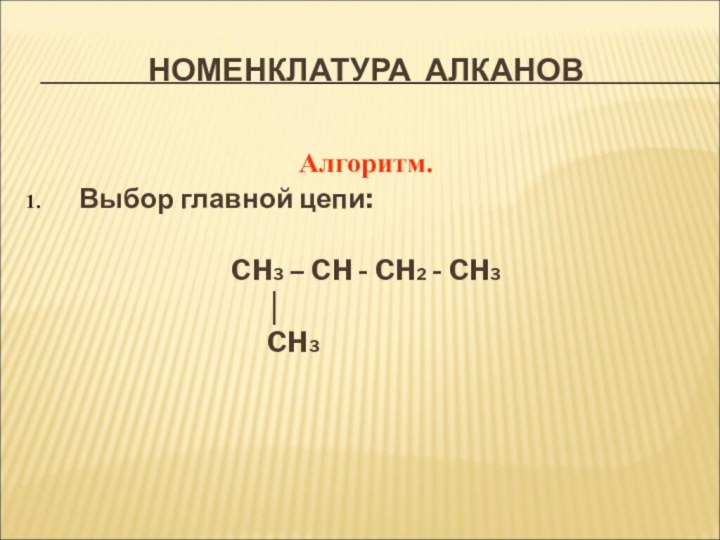
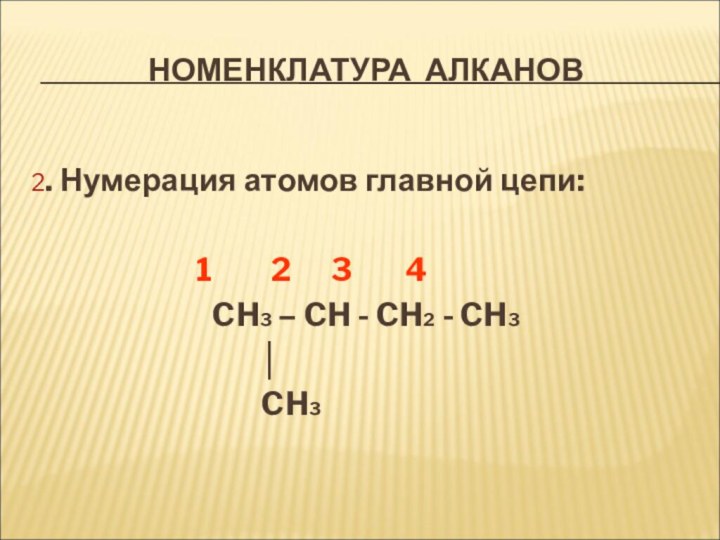
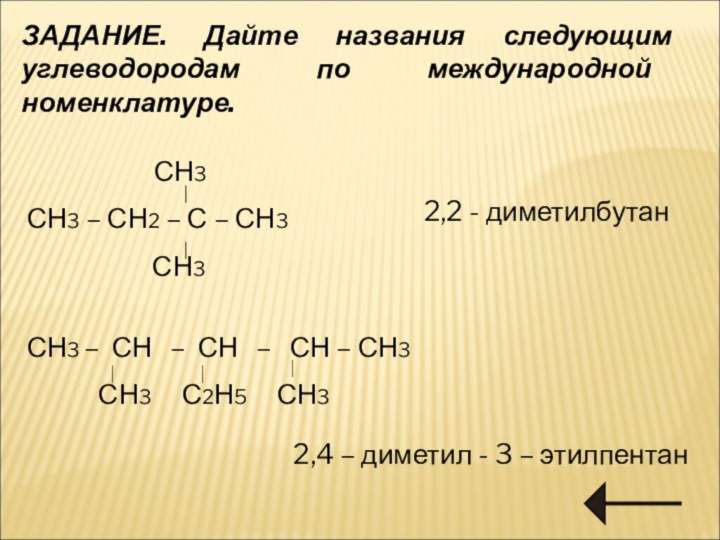
Номенклатура алканов
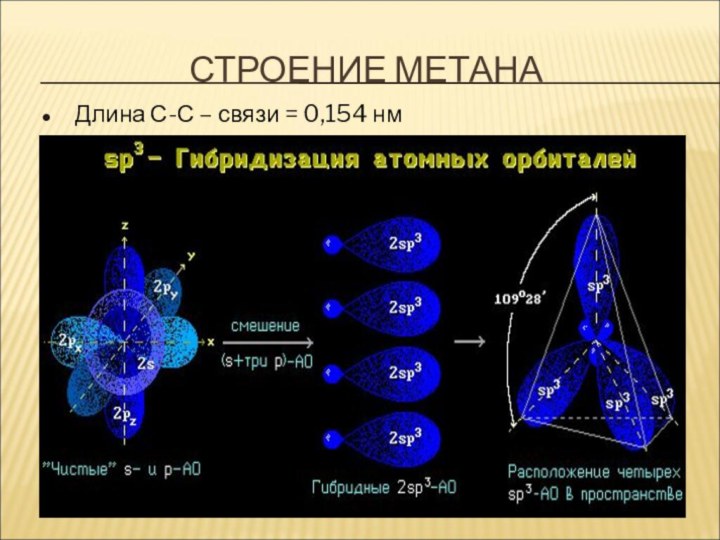
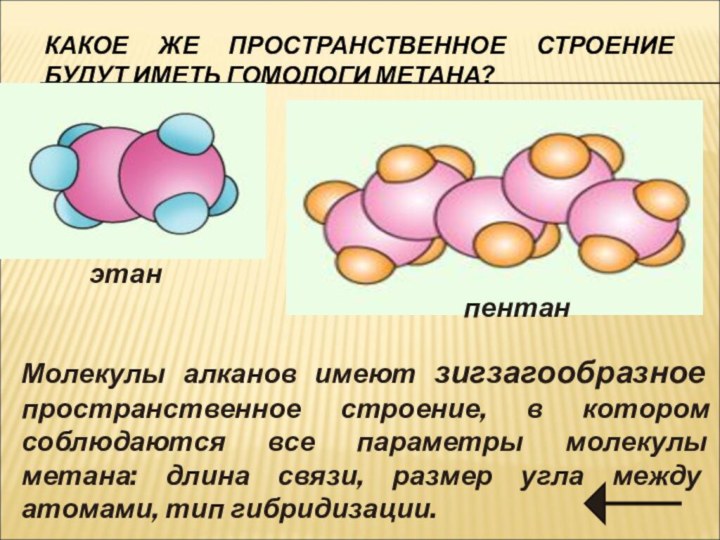
СтроениеСтроение Строение алкановСтроение алканов.
Физические свойстваФизические
свойства.Способы полученияполучения.
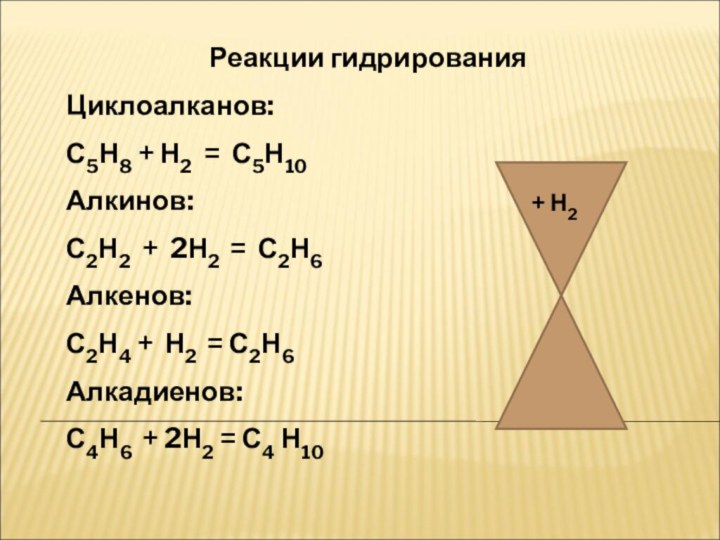
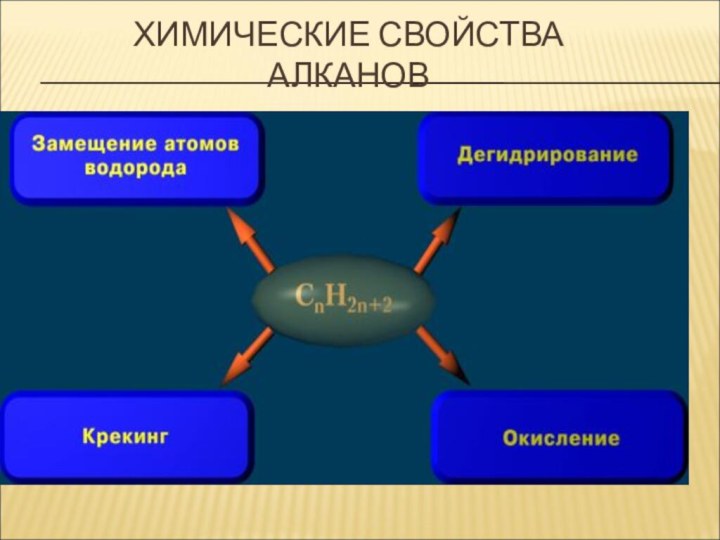
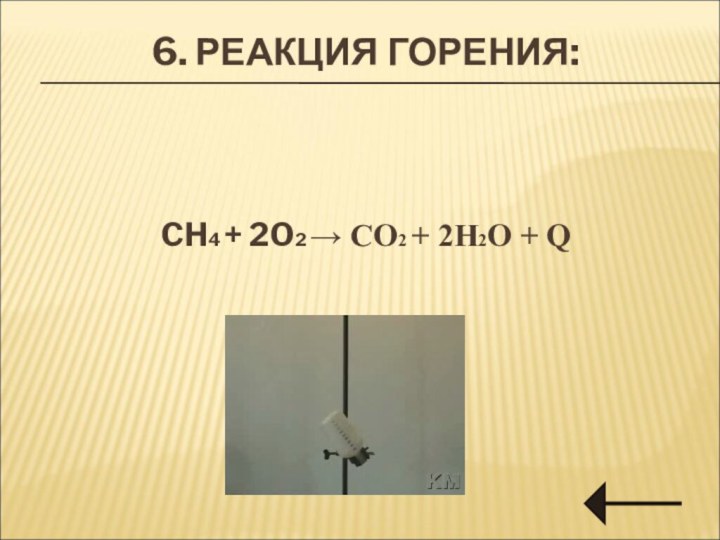
Химические свойстваХимические свойства.
Применение.