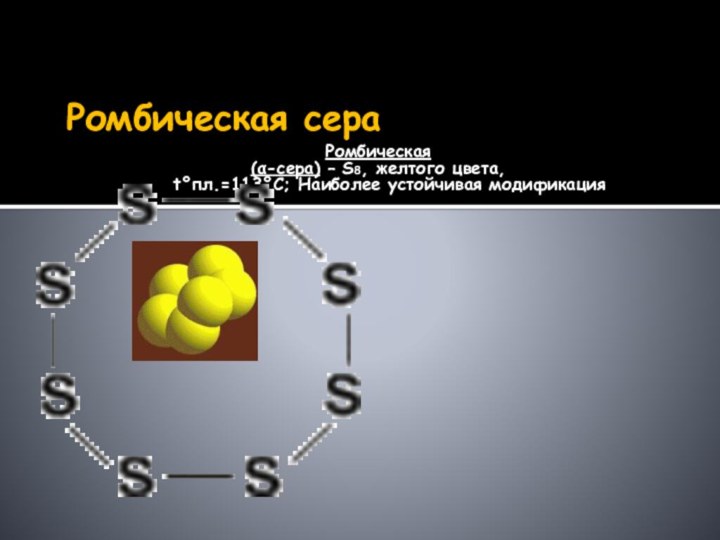
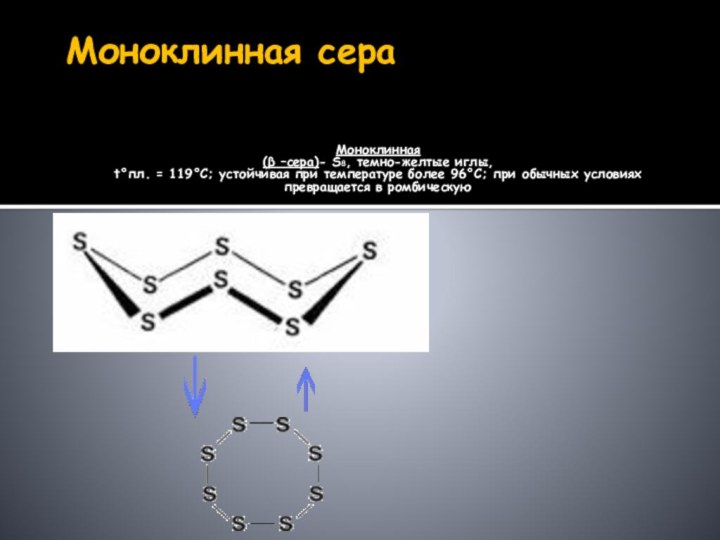
элемента: в форме атомов, простых веществ (аллотропия), а также
некоторых соединений серы.Химические свойства серы рассмотреть в свете ОВР.
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



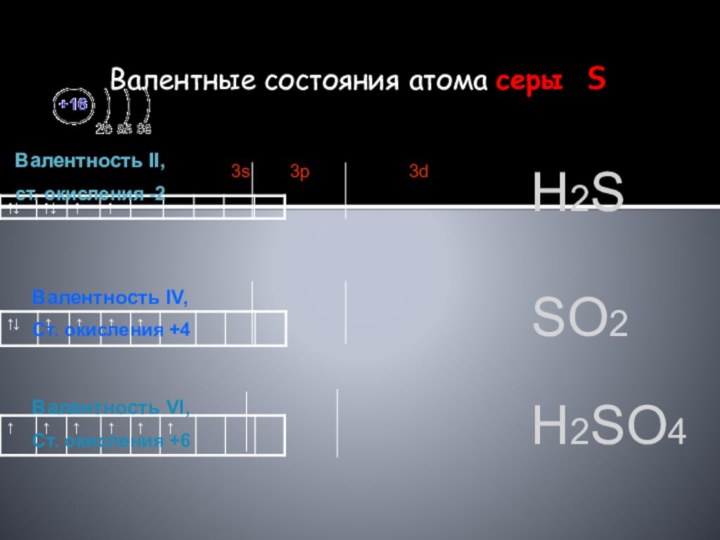










Валентность II,
ст. окисления -2
3s 3p 3d
Валентность IV,
Ст. окисления +4
Валентность VI,
Ст. окисления +6
Н2S
SО2
Н2SО4
Сера в природе