16-00
ЭКЗАМЕН (в K2 в 9-00)
ХЕБО-13-16 13 января 2017
г.ХЕБО-14-16 18 января 2017 г.
ХЕБО-15-16 23 января 2017 г.
ХЕБО-16-16 25 января 2017 г.
ПЕРЕСДАЧА: 30 января в K2 в 9-00
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Email: Нажмите что бы посмотреть



















![Химия элементов 16 (VIA) группы Лекция 1425II. Химия халькогенов. Водородные соединения1.1. Халькогеноводороды.A. Строение.O-II [He]2s22p6](/img/tmb/15/1482439/6fcc11a8bc72257f80b26b252cf94404-720x.jpg)









![Химия элементов 16 (VIA) группы Лекция 339Строение сульфит- и гидросульфит-ионовII. Химия халькогенов. Оксиды ЭO2S+IV [Ne]3s23p0 акцепторO-II [He]2s22p6 донорO-IIнезавершённый тетраэдртаутомерные формы](/img/tmb/15/1482439/97d36552cbf67f7a81f523c14d1484c6-720x.jpg)

![Химия элементов 16 (VIA) группы Лекция 341II. Химия халькогенов. Кислородные соединения1.2. Оксиды ЭO3S+VI [Ne]3s03p0 акцепторO-II [He]2s22p6 донорА.](/img/tmb/15/1482439/57f5a9d9d10321abf120900f14901b3b-720x.jpg)



![Химия элементов 16 (VIA) группы Лекция 345II. Химия халькогенов. Кислородные соединения2. Кислоты H2ЭO4А. Строение и физико-химические свойстваS+VI [Ne]3s03p0](/img/tmb/15/1482439/9eb6e69b9b4ac22b10af3621287d9c06-720x.jpg)
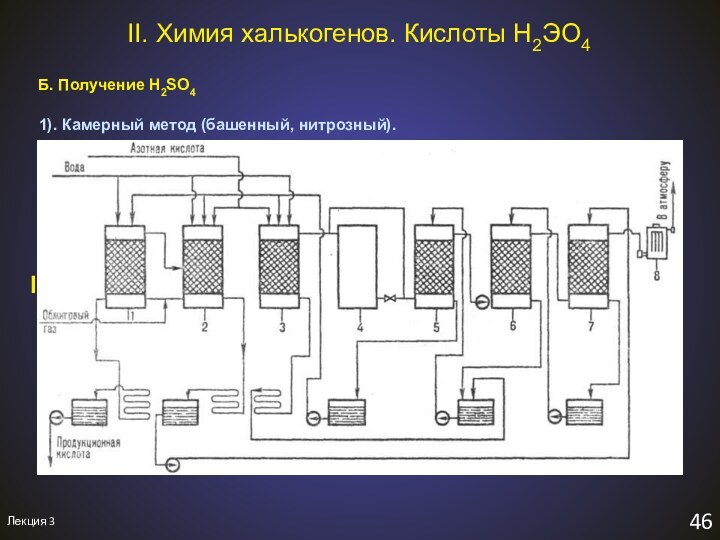
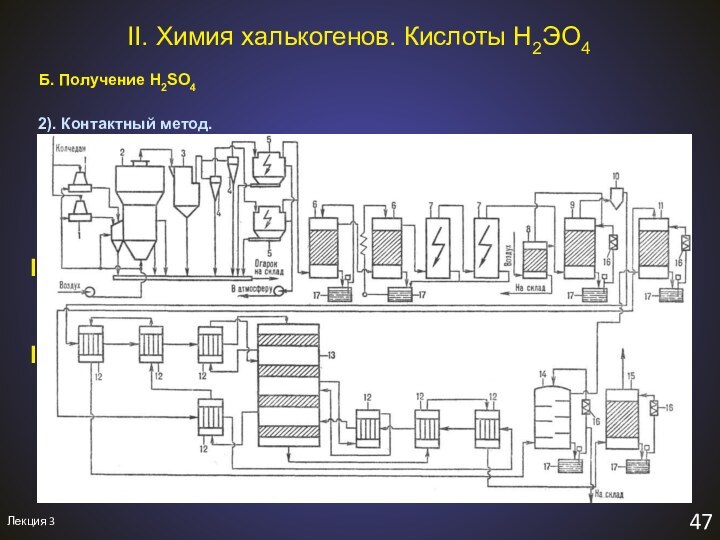














ПЕРЕСДАЧА: 30 января в K2 в 9-00
1
Лекция 3
Tellus - Земля
Лекция 14
2
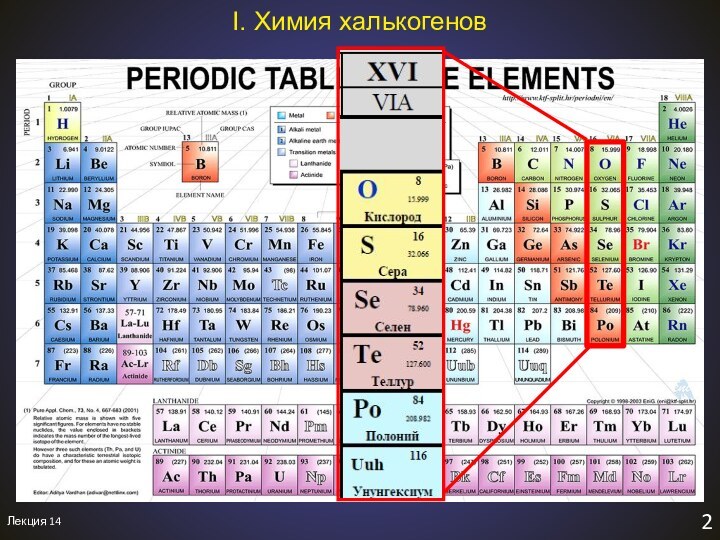
I. Химия халькогенов
Простые вещества – достаточно сильные окислители!
Простые вещества – неметаллы (кроме Po и Lv)!
До завершения подуровня не хватает ⇒ склонность отдавать электроны
двух электронов
Характерные степени окисления:
O: -II, -I, 0, (+II)
S: -II, 0, +IV, +VI
Se: -II, 0, +IV, +VI
Te: -II, 0, +II, +IV, +VI
Po: 0, +II, +IV
Se
tпл = 217 oC
d = 4.79 г/см3
Te
tпл = 449.8 oC
d = 6.25 г/см3
Po
tпл = 254 oC
d = 9.32 г/см3
Период полураспада – 102 года.
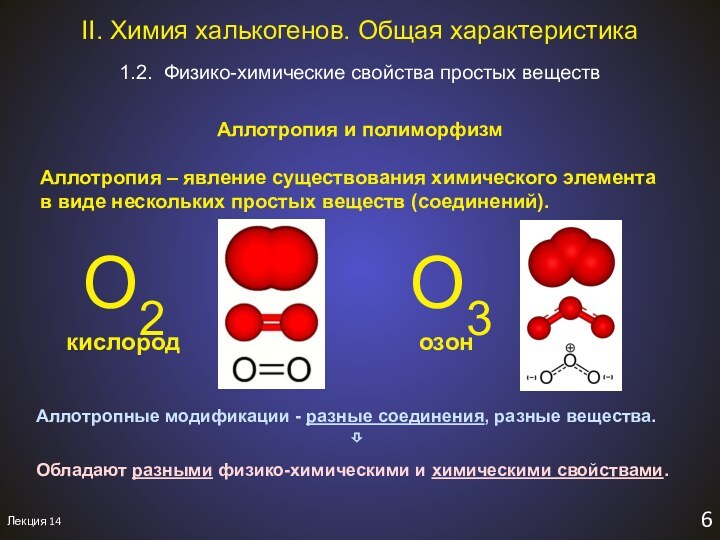
O2
O3
кислород
озон
Аллотропные модификации - разные соединения, разные вещества.
⇩
Обладают разными физико-химическими и химическими свойствами.
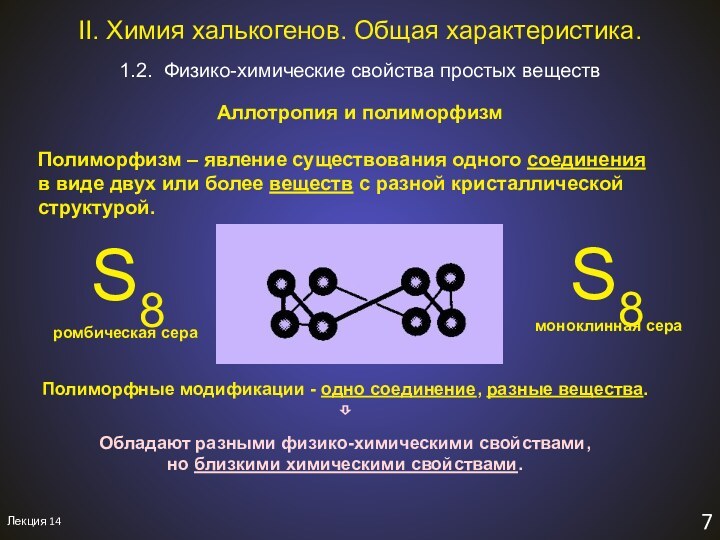
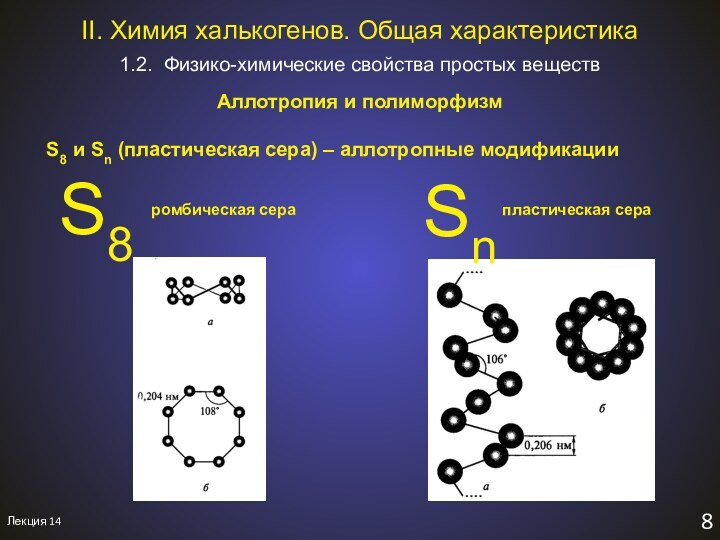
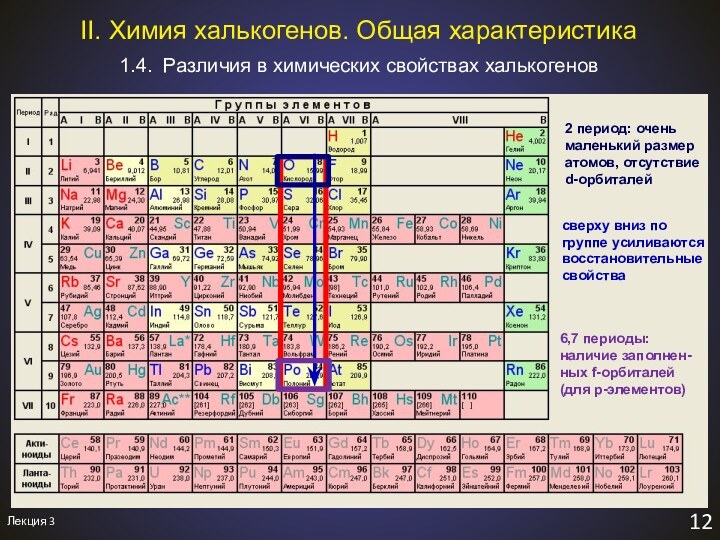
1.2. Физико-химические свойства простых веществ
II. Химия халькогенов. Общая характеристика.
Aллотропия и полиморфизм
S8
S8
ромбическая сера
моноклинная сера
S8
Sn
ромбическая сера
пластическая сера
Б). Восстановительные свойства простых веществ (S, Se, Te)
(с воспламенением)
(с воспламенением)
1.3. Химические свойства, общие для всех элементов групп
Г). Кислотные свойства оксидов (S, Se, Te)
ЭO2 + 2NaOH = Na2ЭO3 + H2O
ЭO3 + 2NaOH = Na2ЭO4 + H2O
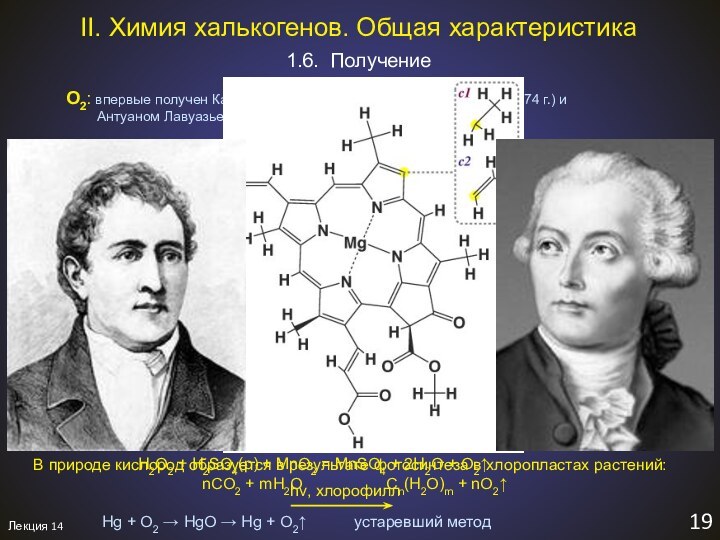
II. Химия халькогенов. Общая характеристика
6,7 периоды: наличие заполнен-ных f-орбиталей (для p-элементов)
окисление органических веществ:
C2H5OH + 3O2 = 2CO2 + 3H2O
(в чистом (особенно жидком) кислороде реакции часто идут со взрывом!)
O2 + HNO3 ≠
6HNO3 + S = H2SO4 + 6NO2 + 2H2O
S (Se) + H2O ≠
Te + 2H2O = TeO2 + 2H2
Po + 2HCl = PoCl2 + H2↑
SO2 + SeO2 = SO3 + Se↓
t
100-160 oC
Б). Реагируют c растворами щелочей
S + 6NaOH = 2Na2S + Na2SO3 + 3H2O
Na2S + (n-1)S = Na2Sn
Na2SO3 + S = Na2SO3S
сульфид
натрия
сульфит
натрия
полисульфид
натрия
тиосульфат
натрия
t
t
t
В). Окисляются кислородом воздуха при нагревании
Г). Реагируют с галогенами (кроме O2)
S + Cl2 = S2Cl2↑
S + 3F2 = SF6↑
t
САМОРОДНАЯ СЕРА
ПИРИТ (FeS2)
ГИПС (CaSO4⋅2H2O)
(«розы пустыни»)
САМОРОДНЫЙ СЕЛЕН
САМОРОДНЫЙ ТЕЛЛУР
1.6. Получение
II. Химия халькогенов. Общая характеристика
Образуется при грозовых разрядах, в процессах с образованием
атомарного кислорода (разложение перекисей, окисление фосфора,
электролиз кислородсодержащих кислот и т.д.).
Озон – сильнейший яд!
ПДК = 10-5 % (~0.1 мл/м3)
t
t
98 % мирового производства полония приходится на Россию.
Гибридизации нет!
угол HOH равен 105о
угол HЭH равен 90о
В образовании связи участвуют
только p-орбитали атома серы
Температура кипения
H2Э(ж) → H2Hal(г)
Чем сильнее взаимодействие
между молекулами жидкости,
тем выше температура кипения.
Tкип ,оС
H2O
H2S
H2Se
H2Te
Халькогеноводороды – бесцветные газы
с очень неприятным запахом.
Лекция 14
27
В. Получение.
II. Химия халькогенов. Водородные соединения
t
Вода – универсальный растворитель.
Вода – амфолит:
H2O + H2O ⮀ H3O+ + OH- автопротолиз воды
Kw = [H3O+][OH-] = 10-14 [H3O+] = [OH-] = 10-7
pH = -lg[H3O+] = -lg(10-7) = 7
H2S, H2Se, H2Te – слабые кислоты:
H2S
H2Se
H2Te
Kк1
Kк1
1.1∙10-7
1.2∙10-13
1.6∙10-4
1.0∙10-11
2.3∙10-3
6.8∙10-13
Восстановительные свойства
Халькогеноводороды – сильнейшие яды!
Б. Растворимость
Разделение катионов металлов (сульфидный метод)
t
1000 oC
1000 oC
Задача 2.
Рассчитайте молярную концентрацию сероводорода в насыщенном растворе
при 20 оС, если его растворимость составляет 258 мл / 100 г H2O.
Задача 3.
Рассчитайте молярную концентрацию сульфид-ионов в насыщенном растворе
сероводорода при 20 оС и pH этого раствора.
Задача 4.
Рассчитайте молярную концентрацию сульфид-ионов в насыщенном растворе
сероводорода при 20 оС, если pH раствора равен 1.
Задача 5.
Определите, выпадет ли осадок сульфида марганца при насыщении раствора
MnSO4 сероводородом при 20 оС.
Г. Восстановительные свойства
2KMnO4 + 4H2O + 3K2S = 2MnO2↓ + 3S↓ + 8KOH
CuS(т) + 8HNO3(конц) = CuSO4 + 8NO2↑ + 4H2O
t
t
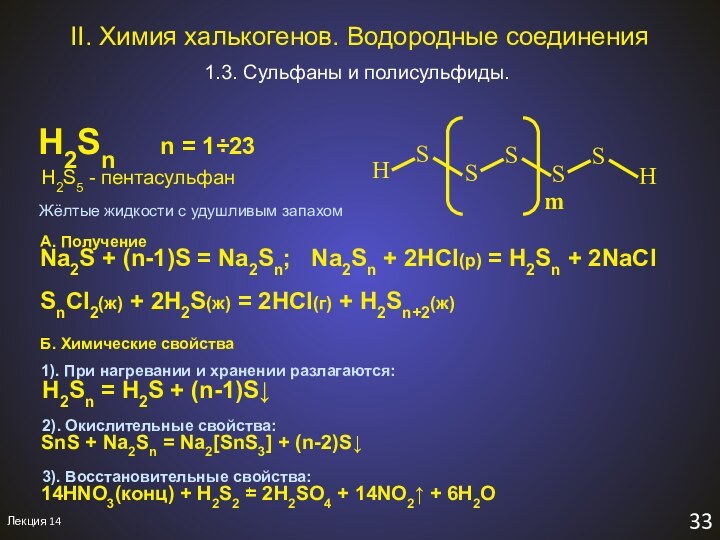
H2S5 - пентасульфан
A. Получение
Na2S + (n-1)S = Na2Sn; Na2Sn + 2HCl(р) = H2Sn + 2NaCl
SnCl2(ж) + 2H2S(ж) = 2HCl(г) + H2Sn+2(ж)
Б. Химические свойства
1). При нагревании и хранении разлагаются:
H2Sn = H2S + (n-1)S↓
2). Окислительные свойства:
SnS + Na2Sn = Na2[SnS3] + (n-2)S↓
Жёлтые жидкости с удушливым запахом
3). Восстановительные свойства:
14HNO3(конц) + H2S2 = 2H2SO4 + 14NO2↑ + 6H2O
t
2KMnO4 + 6H3O+ + 5H2O2 = 5O2↑ + 2Mn2+ + 2K+ + 14H2O
PbO2(т) + H2O2 + 2H3O+ = Pb2+ + 4H2O + O2
PbO2(т) + H2O2 + OH- = [Pb(OH)3]- + O2
В кислой среде: H2O2 + 2H+ + 2ē = 2H2O φo = +1.76 В
В щелочной среде: H2O2 + 2ē = 2OH- φo = +0.94 В
В кислой среде: H2O2 + 2H+ - 2ē = O2 + 2H+ φo = +0.69 В
В щелочной среде: H2O2 + 2OH- - 2e = O2 + 2H2O φo = -0.13 В
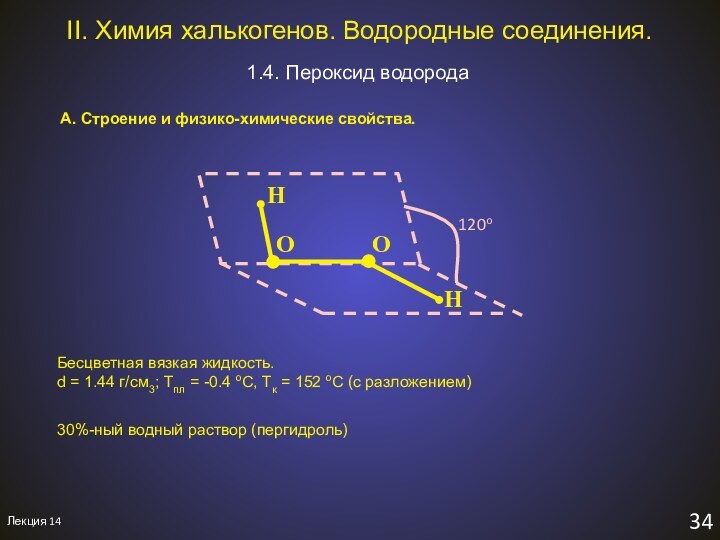
1). Протолиз:
H2O2 + H2O = HO2- + H3O+ слабая кислота (Кк = 2.38∙10-12)
незавершённый треугольник
По правилу Поллинга:
NO – NH = 3 – 2 = 1
⇩
cлабые кислоты
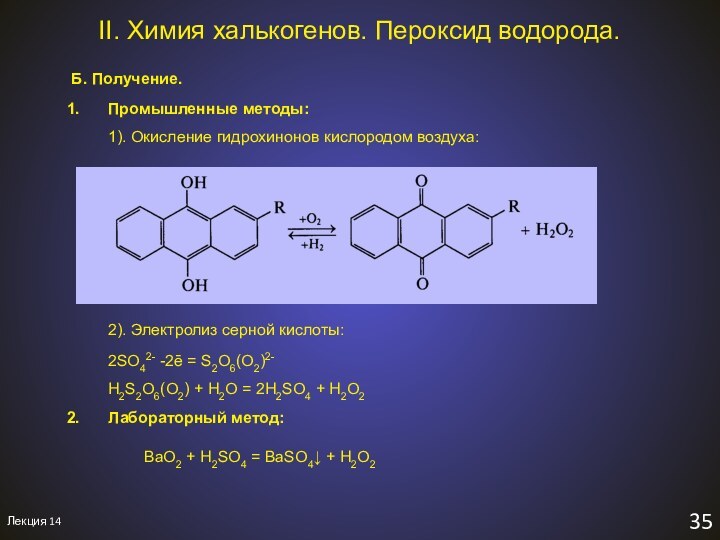
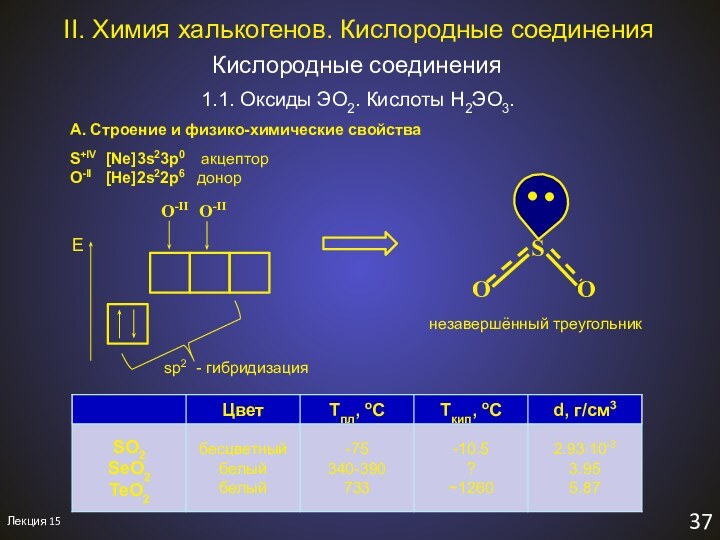
II. Химия халькогенов. Оксиды ЭO2
сернистая кислота
гидросульфит-ион
селенистая
кислота
2). Кислотные свойства:
SO2 + 2NaOH = Na2SO3 + H2O
SO2 + H2O + Na2SO3 = 2NaHSO3
сульфит натрия
гидросульфит натрия
TeO2 в воде практически нерастворим
TeO2 – амфотерен!
4). Окислительные свойства:
SO2 + 2H2 = S + 2H2O
SO2 + H2S = S + H2O
В реакциях с сильными восстановителями
Аналогичные свойства проявляют сернистая кислота и её соли:
5Na2SO3 + 6H3O+ + 2KMnO4 = 5Na2SO4 + 2Mn2+ + 2K+ + 9H2O
2SO2∙H2O + Zn = ZnS2O4 + 2H2O
дитионит
цинка
t
t
400-620 oC, кат.
t
серная кислота
селеновая кислота
олеум
1). Термическое разложение:
ЭO3 = ЭO2 + O2
t
Температура разложения, oC:
SO3 ~450
SeO3 ~240
TeO3 ~360
4). Окислительные свойства:
2SO3 + C = CO2 + SO2
2SO3 + 2HCl = SO2↑+ Cl2↑ + H2SO4
2SO3 + 8HI = H2S + 4I2 + 3H2O
SeO3 + 2HCl = H2SeO3 + Cl2
Смеси SeO3 с органическими веществами взрываются!
t
Сильные окислители
SO3 < SeO3 > TeO3
окислительная способность
0 oC
0 oC
t
t
олеум
t
t
В. Получение H2SеO4 и H2TеO4
Se + 3Cl2 + 4H2O = H2SеO4 + 6HCl
H2SeO3 + H2O2 = H2SeO4 + H2O
сильные кислоты
2). Кислотные свойства:
H2SO4(р) + Zn = ZnSO4 + H2
H2SO4 + 2NaOH = Na2SO4 + 2H2O
3H2SO4 + Fe2O3 = Fe2(SO4) 3+ 3H2O
в разбавленном виде –
кислоты-неокислители.
В концентрированном виде – сильные окислители!
Окислительная способность: H2SO4 < H2SeO4 > H2TeO4
t
6H2SеO4(конц) + 2Au = Au2(SeO4)3 + 3H2SeO3 + 3H2O
4). Водоотнимающие свойства H2SO4
H2SO4(конц) + nH2O = H2SO4∙nH2O + Q
H2SO4(конц) + C2H5OH = H2SO4∙H2O + C2H4↑
xH2SO4(конц) + Cn(H2O)m = nC + xH2SO4∙(H2O)m/x
обугливание органических соединений
(дегидратация)
полисульфаты – бесцветные
кристаллические вещества
H2S2O7 – дисерная (пиросерная) кислота
K2S2O7 – дисульфат (пиросульфат калия)
В. Химические свойства
H2S2O7 + H2O = 2H2SO4
K2S2O7 + H2O = 2KHSO3
1). В водных растворах:
свойства в водных растворах
идентичны свойствам H2SO4 и KHSO3
2). В твёрдом виде:
Al2O3 + 3K2S2O7 = 3K2SO4 + Al2(SO4)3
Cr2O3 + 3K2S2O7 = 3K2SO4 + Cr2(SO4)3
перевод инертных оксидов
в растворимое состояние
t
t
t
эфир
-78 оС
t
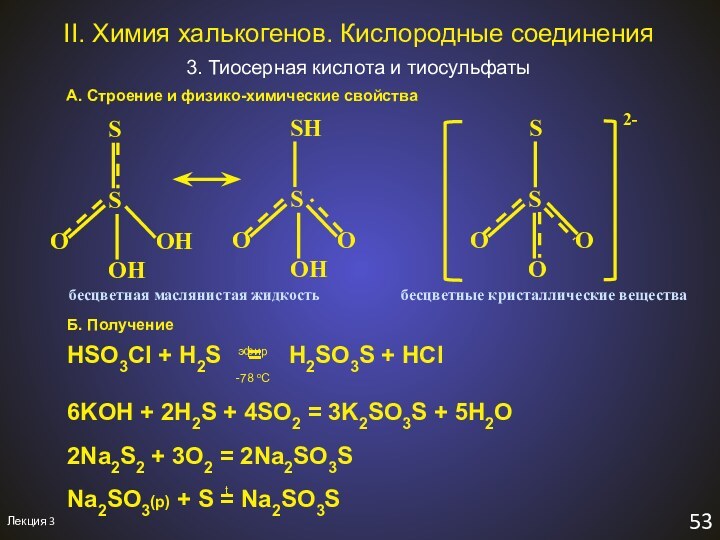
бесцветная маслянистая жидкость
бесцветные кристаллические вещества
SO3S2- + 2H3O+ = SO2↑ + S↓ + 3H2O
3). Восстановительные свойства
SO3S2- + I2 = S4O62- + 2I-
SO3S2- + 4Cl2 + 5H2O = 2SO42- + 10H+ + 8Cl-
тетратионат-
ион
при действии слабых окислителей
при действии сильных окислителей
t
3). Окислительные свойства
3SO3S2- + 8Al + 14OH- + 9H2O = 6S2- + 8[Al(OH)4]-
при действии сильных восстановителей
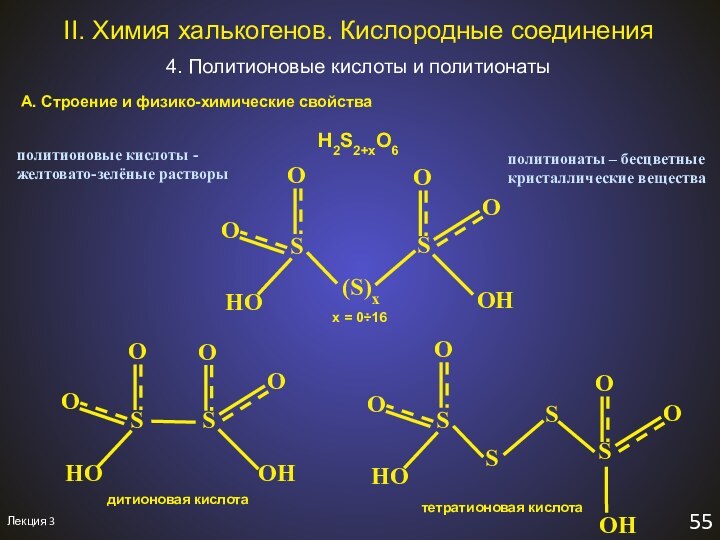
политионаты – бесцветные
кристаллические вещества
H2S2+xO6
2Na2SO3S + SCl2 = Na2S5O6 + 2NaCl
2Na2SO3S + H2O2 = Na2S3O6 + Na2SO4 + 3H2O
2). Восстановительные свойства
S2O62- + 2H2O – 2ē = 2SO42- + 4H+
при действии сильных окислителей
S2O62- + 2ē = 2SO32-
3). Окислительные свойства
при действии сильных восстановителей
t
t
H2S2+xO6 = H2S2+x-yO6 + yS↓
t
H2S2+xO6 = H2SO4 + SO2 + xS↓
медленное разложение при хранении
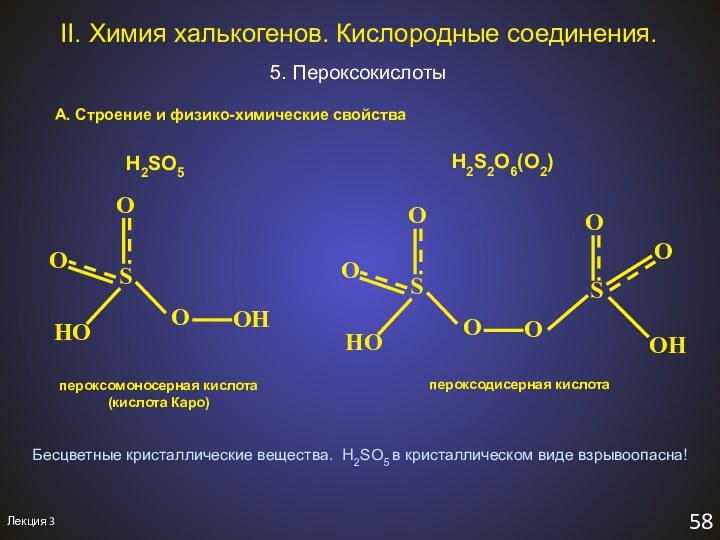
H2SO5
H2S2O6(O2)
электролиз серной кислоты или сульфатов
HSO3Cl + H2O2(безводн.) = H2SO5 + HCl
K2S2O8 + H2O + H2SO4(конц) = H2SO5 + 2KHSO4
1). Термическое разложение
2). Протолиз
H2S2O8 + 2H2O = S2O82- + 2H3O+
H2SO5 + H2O = HSO5- + H3O+
t
t
на холоду
Ag+
S2O82- + 2ē = 2SO42- Eo = 2.01 В >> 1В ? очень сильный окислитель!