- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему по химии Неметаллы ( 9, 11 классы)
Содержание
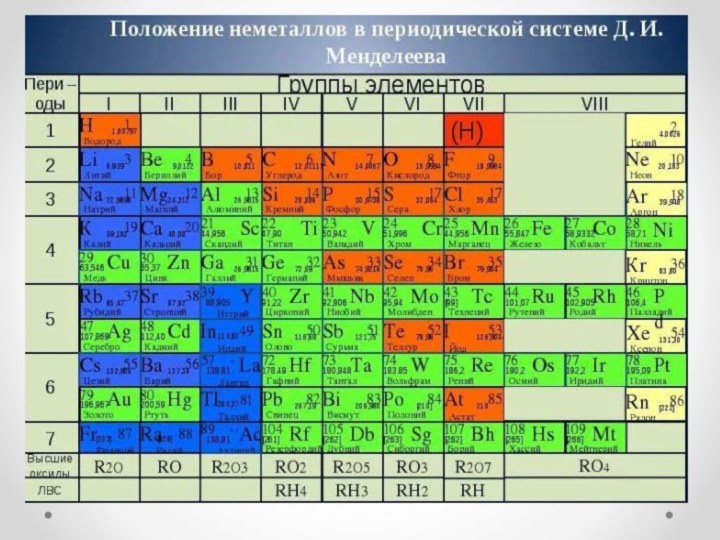
- 10. Неметаллы – химические элементы, атомы которых принимают электроны
- 16. Химия неметалловМногие
- 17. Диспропорционирование
- 18. Получение неметаллов Многообразие неметаллов породило многообразие способов
- 21. Роль неметаллов в жизни человека Неметаллы в
- 22. Осуществите превращение
- 23. Скачать презентацию
- 24. Похожие презентации
Неметаллы – химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают










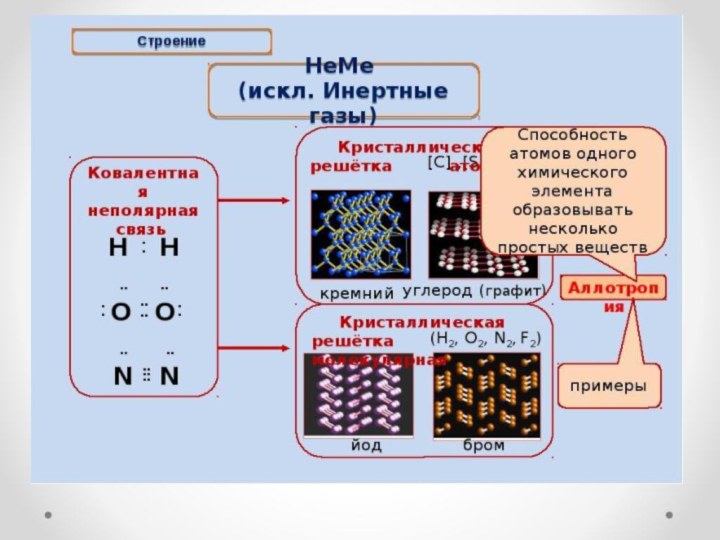










Слайд 15
Химия неметаллов
Любой неметалл выступает в роли
окислителя в реакциях с теми неметаллами, которые имеют более низкую ЭО. Например:2P + 5S = P2S5
В этой реакции сера – окислитель, а фосфор – восстановитель, так как ЭО фосфора меньше ЭО серы.
Слайд 16
Химия неметаллов
Многие неметаллы
выступают в роли восстановителей в реакциях со сложными веществами-окислителями:
—
взаимодействие с кислотами-окислителями:S + 6HNO = H2SO4 + 6NO2 + 2H2O
— взаимодействие с солями-окислителями:
6P + 5KClO3 = 5KCl + 3P2O5
Слайд 18
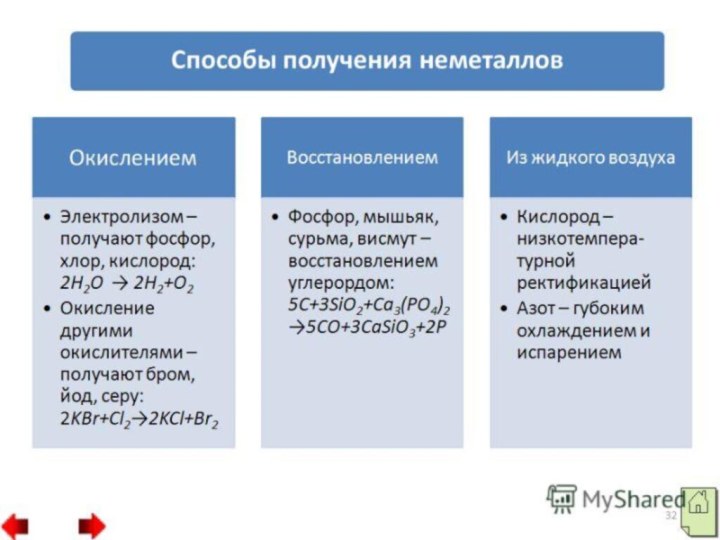
Получение неметаллов
Многообразие неметаллов породило многообразие способов их получения,
так водород получают, как лабораторными способами, например, взаимодействием металлов
с кислотами (1), так и промышленными способами, например, конверсией метана (2).Zn +2HCl = ZnCl2 + H2 ↑
CH4 + H2O = CO + 3H2 ↑ (температура 900 С)
Получение галогенов осуществляют в основном, путем окисления галогеноводородных кислот:
MnO2 +4HCl = MnCl2 + Cl2↑ + 2H2O
K2Cr2O7 +14HCl= 3Cl2↑ + 2KCl +2CrCl3 +7H2O
2KMnO4 +16HCl = 2 MnCl2 +5Cl2↑ +8H2O+ 2KCl
Слайд 21
Роль неметаллов в жизни человека
Неметаллы в жизни человека
играют огромную роль, так как без них невозможна жизнь
не только человека, но и других живых организмов.Благодаря таким неметаллическим элементам, как кислород, углерод, водород и азот, образуются аминокислоты, из которых затем образуются белки, без чего не может существовать все живое на Земле. Такой необходимый микроэлемент, как сера, в организме человека выступает в роли минерала красоты, так как благодаря ней, кожа, ногти и волосы, будут оставаться здоровыми. Также, не стоит забывать, что сера принимает участие в формировании хрящевой и костных тканей, помогает улучшить работу суставов, укрепляет нашу мышечную ткань и выполняет еще много других функций, которые очень важны для здоровья человека.
Анионы хлора также играют важную биологическую роль для человека, так как принимают участие в активизации некоторых ферментов. С их помощью поддерживается благоприятная среда в желудке и поддерживается осмотическое давление.





























