Слайд 2
Белки — высокомолекулярные органические соединения, состоящие из остатков
α-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера.
Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин — 36 000, гемоглобин — 152 000, миозин — 500 000. Для сравнения: молекулярная масса спирта — 46, уксусной кислоты — 60, бензола — 78.
Строение белков
Слайд 3
Белки — непериодические полимеры, мономерами которых являются α-аминокислоты.
Обычно в качестве мономеров белков называют 20 видов α-аминокислот,
хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты — могут синтезироваться; незаменимые аминокислоты — не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
Аминокислотный состав белков
Слайд 4
В зависимости от аминокислотного состава, белки бывают: полноценными
— содержат весь набор аминокислот; неполноценными — какие-то аминокислоты
в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными. Простетическая группа может быть представлена металлами (металлопротеины), углеводами (гликопротеины), липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины).
Слайд 5
Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2)
аминогруппу (–NH2), 3) радикал или R-группу (остальная часть молекулы).
Строение радикала у разных видов аминокислот — различное. В зависимости от количества аминогрупп и карбоксильных групп, входящих в состав аминокислот, различают: нейтральные аминокислоты, имеющие одну карбоксильную группу и одну аминогруппу; основные аминокислоты, имеющие более одной аминогруппы; кислые аминокислоты, имеющие более одной карбоксильной группы.
Аминокислоты являются амфотерными соединениями, так как в растворе они могут выступать как в роли кислот, так и оснований. В водных растворах аминокислоты существуют в разных ионных формах.
Слайд 6
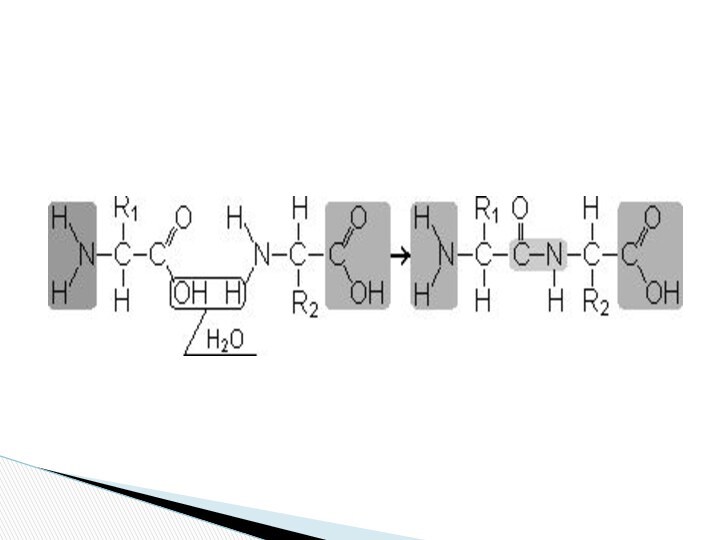
Пептиды — органические вещества, состоящие из остатков аминокислот,
соединенных пептидной связью.
Образование пептидов происходит в результате реакции конденсации
аминокислот. При взаимодействии аминогруппы одной аминокислоты с карбоксильной группой другой между ними возникает ковалентная азот-углеродная связь, которую и называют пептидной. В зависимости от количества аминокислотных остатков, входящих в состав пептида, различают дипептиды, трипептиды, тетрапептиды и т.д. Образование пептидной связи может повторяться многократно. Это приводит к образованию полипептидов. На одном конце пептида находится свободная аминогруппа (его называют N-концом), а на другом — свободная карбоксильная группа (его называют С-концом).
Пептидная связь
Слайд 8
Выполнение белками определенных специфических функций зависит от пространственной
конфигурации их молекул, кроме того, клетке энергетически невыгодно держать
белки в развернутой форме, в виде цепочки, поэтому полипептидные цепи подвергаются укладке, приобретая определенную трехмерную структуру, или конформацию. Выделяют 4 уровня пространственной организации белков.
Пространственная организация белковых молекул
Слайд 9
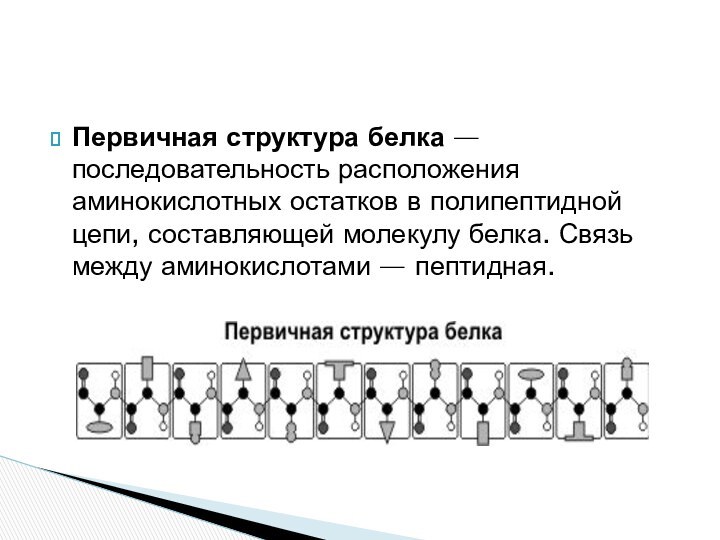
Первичная структура белка — последовательность расположения аминокислотных остатков
в полипептидной цепи, составляющей молекулу белка. Связь между аминокислотами
— пептидная.
Слайд 10
Если молекула белка состоит всего из 10 аминокислотных
остатков, то число теоретически возможных вариантов белковых молекул, отличающихся
порядком чередования аминокислот, — 1020. Имея 20 аминокислот, можно составить из них еще большее количество разнообразных комбинаций. В организме человека обнаружено порядка десяти тысяч различных белков, которые отличаются как друг от друга, так и от белков других организмов.
Слайд 11
Именно первичная структура белковой молекулы определяет свойства молекул
белка и ее пространственную конфигурацию. Замена всего лишь одной
аминокислоты на другую в полипептидной цепочке приводит к изменению свойств и функций белка. Например, замена в β-субъединице гемоглобина шестой глутаминовой аминокислоты на валин приводит к тому, что молекула гемоглобина в целом не может выполнять свою основную функцию — транспорт кислорода; в таких случаях у человека развивается заболевание — серповидноклеточная анемия.
Слайд 12
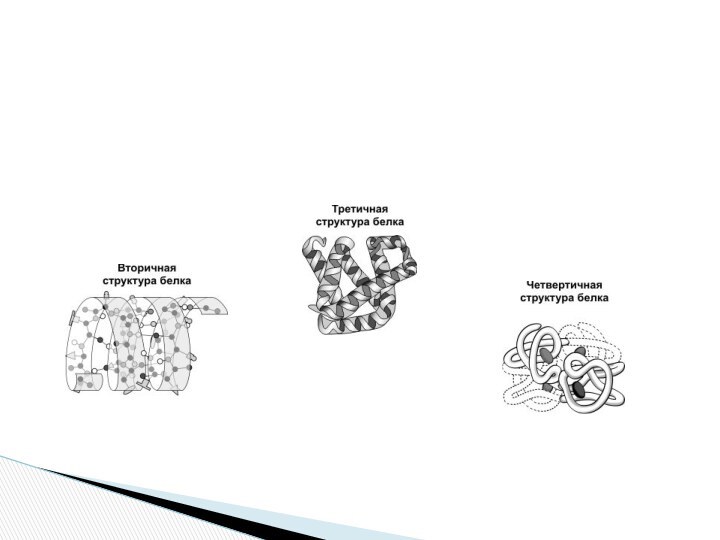
Вторичная структура — упорядоченное свертывание полипептидной цепи в
спираль (имеет вид растянутой пружины). Витки спирали укрепляются водородными
связями, возникающими между карбоксильными группами и аминогруппами. Практически все СО- и NН-группы принимают участие в образовании водородных связей. Они слабее пептидных, но, повторяясь многократно, придают данной конфигурации устойчивость и жесткость. На уровне вторичной структуры существуют белки: фиброин (шелк, паутина), кератин (волосы, ногти), коллаген (сухожилия).
Слайд 14
Третичная структура — укладка полипептидных цепей в глобулы,
возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных)
и установления гидрофобных взаимодействий между радикалами аминокислотных остатков. Основную роль в образовании третичной структуры играют гидрофильно-гидрофобные взаимодействия. В водных растворах гидрофобные радикалы стремятся спрятаться от воды, группируясь внутри глобулы, в то время как гидрофильные радикалы в результате гидратации (взаимодействия с диполями воды) стремятся оказаться на поверхности молекулы. У некоторых белков третичная структура стабилизируется дисульфидными ковалентными связями, возникающими между атомами серы двух остатков цистеина. На уровне третичной структуры существуют ферменты, антитела, некоторые гормоны.
Слайд 16
Четвертичная структура характерна для сложных белков, молекулы которых
образованы двумя и более глобулами. Субъединицы удерживаются в молекуле
благодаря ионным, гидрофобным и электростатическим взаимодействиям. Иногда при образовании четвертичной структуры между субъединицами возникают дисульфидные связи. Наиболее изученным белком, имеющим четвертичную структуру, является гемоглобин. Он образован двумя α-субъединицами (141 аминокислотный остаток) и двумя β-субъединицами (146 аминокислотных остатков). С каждой субъединицей связана молекула гема, содержащая железо.
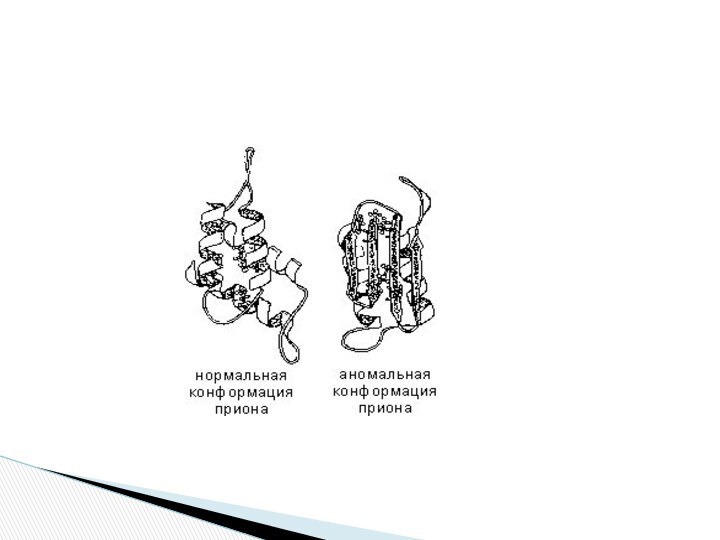
Если по каким-либо причинам пространственная конформация белков отклоняется от нормальной, белок не может выполнять свои функции. Например, причиной «коровьего бешенства» (губкообразной энцефалопатии) является аномальная конформация прионов — поверхностных белков нервных клеток.
Слайд 17
Аминокислотный состав, структура белковой молекулы определяют его свойства.
Белки сочетают в себе основные и кислотные свойства, определяемые
радикалами аминокислот: чем больше кислых аминокислот в белке, тем ярче выражены его кислотные свойства. Способность отдавать и присоединять Н+ определяют буферные свойства белков; один из самых мощных буферов — гемоглобин в эритроцитах, поддерживающий рН крови на постоянном уровне. Есть белки растворимые (фибриноген), есть нерастворимые, выполняющие механические функции (фиброин, кератин, коллаген). Есть белки активные в химическом отношении (ферменты), есть химически неактивные, устойчивые к воздействию различных условий внешней среды и крайне неустойчивые.
Свойства белков
Слайд 18
Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и

их соли, изменения рН, радиация, обезвоживание)
могут вызывать нарушение
структурной организации молекулы белка. Процесс утраты трехмерной конформации, присущей данной молекуле белка, называют денатурацией. Причиной денатурации является разрыв связей, стабилизирующих определенную структуру белка. Первоначально рвутся наиболее слабые связи, а при ужесточении условий и более сильные. Поэтому сначала утрачивается четвертичная, затем третичная и вторичная структуры. Изменение пространственной конфигурации приводит к изменению свойств белка и, как следствие, делает невозможным выполнение белком свойственных ему биологических функций. Если денатурация не сопровождается разрушением первичной структуры, то она может быть обратимой, в этом случае происходит самовосстановление свойственной белку конформации. Такой денатурации подвергаются, например, рецепторные белки мембраны. Процесс восстановления структуры белка после денатурации называется ренатурацией. Если восстановление пространственной конфигурации белка невозможно, то денатурация называется необратимой.
Слайд 19
Тема: «Белки»
Необходимые пояснения:
средняя молекулярная масса одного аминокислотного остатка
принимается за 120;
вычисление молекулярной массы белка:
где Мmin
– минимальная молекулярная масса белка,
а – атомная или молекулярная масса компонента,
в – процентное содержание компонента.
Задача № 1. Гемоглобин крови человека содержит 0,34% железа. Вычислите минимальную молекулярную массу гемоглобина.
Решение:
Мmin = 56 : 0,34% × 100% = 16 471
Задача № 2. Альбумин сыворотки крови человека имеет молекулярную массу 68400. Определите количество аминокислотных остатков в молекуле этого белка.
Решение:
68400 : 120 = 570 (аминокислот в молекуле альбумина).
Задача № 3. Белок содержит 0,5% глицина. Чему равна минимальная молекулярная масса этого белка, если Мглицина = 75,1? Сколько аминокислотных остатков в этом белке?
Решение:
1) Мmin = 75,1 : 0,5% × 100% = 15 020
2) 15 020 : 120 = 125 (аминокислот в этом белке)
Слайд 20
Необходимые пояснения:
относительная молекулярная масса одного нуклеотида принимается за

345;
расстояние между нуклеотидами в цепи молекулы ДНК (длина
одного нуклеотида) – 0, 34 нм;
Правила Чаргаффа:
1. ∑(А) = ∑(Т)
2. ∑(Г) = ∑(Ц)
3. ∑(А+Г) =∑(Т+Ц)
Задача № 4. На фрагменте одной нити ДНК нуклеотиды расположены в последовательности:
А–А–Г–Т–Ц–Т–А–Ц–Г–Т–А–Т
Определите процентное содержание всех нуклеотидов в этом фрагменте ДНК и длину гена.
Решение:
1) достраиваем вторую нить (по принципу комплементарности)
2) ∑(А +Т+Ц+Г) = 24,
из них ∑(А) = 8 = ∑(Т)
24 – 100%
8 – х%
х = 33,4%
∑(Г) = 4 = ∑(Ц)
24 – 100%
4 – х%
х = 16,6%
3) молекула ДНК двуцепочечная, поэтому длина гена равна длине одной цепи:
12 × 0,34 = 4,08 нм
Задача № 5. В молекуле ДНК на долю цитидиловых нуклеотидов приходится 18%. Определите процентное содержание других нуклеотидов в этой ДНК.
Решение:
1) т.к. Ц = 18%, то и Г = 18%;
2) на долю А+Т приходится 100% – (18% +18%) = 64%, т.е. по 32%
Ответ: Г и Ц – по 18%, А и Т – по 32%.
Тема: «Нуклеиновые кислоты»
Слайд 21
Задача № 6. В молекуле ДНК обнаружено 880

гуанидиловых нуклеотидов, которые составляют 22% от общего числа нуклеотидов
в этой ДНК.
Определите:
а) сколько других нуклеотидов в этой ДНК?
б) какова длина этого фрагмента?
Решение:
1) ∑(Г) = ∑(Ц)= 880 (это 22%);
На долю других нуклеотидов приходится 100% – (22%+22%)= 56%, т.е. по 28%;
Для вычисления количества этих нуклеотидов составляем пропорцию:
22% – 880
28% – х, отсюда х = 1120
2) для определения длины ДНК нужно узнать, сколько всего нуклеотидов содержится в 1 цепи:
(880 + 880 + 1120 + 1120) : 2 = 2000
2000 × 0,34 = 680 (нм)
Задача № 7. Дана молекула ДНК с относительной молекулярной массой 69 000, из них 8625 приходится на долю адениловых нуклеотидов.
Найдите количество всех нуклеотидов в этой ДНК. Определите длину этого фрагмента.
Решение:
1) 69 000 : 345( масса гена) = 200 (нуклеотидов в ДНК),
8625 : 345 (масса гена)= 25 (адениловых нуклеотидов в этой ДНК),
∑(Г+Ц) = 200 – (25+25)= 150, т.е. их по 75;
2) 200 нуклеотидов в двух цепях, значит в одной – 100.
100 × 0,34 = 34 (нм)
Слайд 22
Задача № 8. Что тяжелее: белок или его
ген?
Решение:
Пусть х – количество аминокислот в белке, тогда масса
этого белка – 120х, количество нуклеотидов в гене, кодирующем этот белок, – 3х, масса этого гена – 345 × 3х.
120х < 345 × 3х
Ответ: ген тяжелее белка.
Задача № 9. Последовательность нуклеотидов в начале гена, хранящего информацию о белке инсулине, начинается так:
А–А–А–Ц–А–Ц–Ц–Т–Г–Ц–Т–Т–Г–Т–А–Г–А–Ц
Напишите последовательности аминокислот, которой начинается цепь инсулина.
Решение:
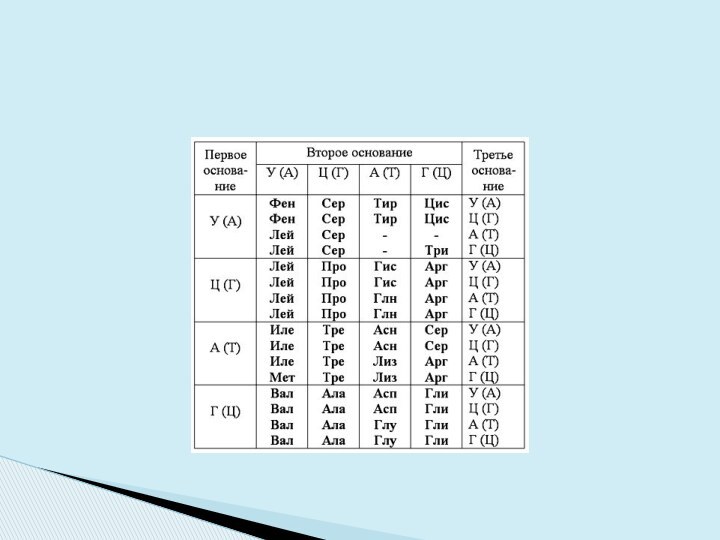
Задание выполняется с помощью таблицы, в которой нуклеотиды в иРНК (в скобках – в исходной ДНК) соответствуют аминокислотным остаткам.
Генетический код
Двадцать аминокислот, входящих в состав белков
Ответ: фенилаланин – валин – аспарагиновая кислота – глутаминовая кислота – гистидин – лейцин.
Тема: «Код ДНК»
Слайд 24
Задача № 10. Вирусом табачной мозаики (РНК-содержащий вирус)
синтезируется участок белка с аминокислотной последовательностью:
Ала – Тре
– Сер – Глу – Мет-
Под действием азотистой кислоты (мутагенный фактор) цитозин в результате дезаминирования превращается в урацил. Какое строение будет иметь участок белка вируса табачной мозаики, если все цитидиловые нуклеотиды подвергнутся указанному химическому превращению?
Решение:
Ала – Тре – Сер – Глу – Мет-
ГЦУ – АЦГ – АГУ – ГАГ – АУГ
ГУУ – АУГ – АГУ – ГАГ – АУГ
Вал – Мет – Сер – Глу – Мет-
Слайд 25
Задача № 11. В процессе энергетического обмена произошло

расщепление 7 моль глюкозы, из которых полному расщеплению подверглось
только 2. Определите:
а) сколько моль молочной кислоты и СО2 при этом образовалось;
б) сколько АТФ при этом синтезировано;
в) сколько энергии запасено в этих молекулах АТФ;
г) сколько израсходовано моль О2?
Решение:
5 С6Н12О6 → 5 × 2 С3Н6О3 + 5 × 2 АТФ
2 С6Н12О6 + 2 × 6 О2 → 2 × 6 СО2 + 2 × 6 Н2О + 2 × 38 АТФ
Ответ:
а) 10 моль С3Н6О3 и 12 моль СО2;
б) 10 + 76 = 86 (молекул АТФ);
в) 86 × 40 = 3440 (кДж энергии);
г) 12 моль О2.
Задача № 12. В результате энергетического обмена в клетке образовалось 5 моль молочной кислоты и 27 моль углекислого газа. Определите:
а) сколько всего моль глюкозы израсходовано;
б) сколько из них подверглось полному расщеплению, а сколько гликолизу;
в) сколько энергии запасено;
г) сколько моль кислорода пошло на окисление?
Решение:
2,5 С6Н12О6 → 2,5 × 2 С3Н6О3 + 2,5 × 2 АТФ
4,5 С6Н12О6 + 4,5 × 6 О2 → 4,5 × 6 СО2 + 4,5 × 6 Н2О + 4,5 × 38 АТФ
Ответ:
а) 7 моль С6Н12О66;
б) 4,5 моль – полному расщеплению, 2,5 – гликолизу;
в) (2,5 × 2 + 4,5 × 38) × 40 = 7040 (кДж);
г) 27 моль О2.
Тема: «Энергетический обмен»
Слайд 26
Задача № 13. Мышцы ног при беге со

средней скоростью расходуют за 1 мин 24 кДж энергии.
Определите:
а) сколько всего граммов глюкозы израсходуют мышцы ног за 25 мин бега, если кислород доставляется кровью к мышцам в достаточном количестве;
б) накопится ли в мышцах молочная кислота?
Решение:
Х = 600 × 180 : 1520 = 71 (г)
Ответ:
а) 71 г;
б) нет, т.к. О2 достаточно.
Задача № 14. Мышцы руки при выполнении вольных упражнений расходуют за 1 мин 12 кДж энергии. Определите:
а) сколько всего граммов глюкозы израсходуют мышцы руки за 10 мин, если кислород доставляется кровью к мышцам в достаточном количестве;
б) накопится ли в мышцах молочная кислота?
Решение:
Х = 120 × 180 : 1520 = 14,2 (г)
Ответ:
а) 14,2 г;
б) нет, т.к. О2 достаточно.
Задача № 15. Бегун расходует за 1 мин 24 кДж энергии. Сколько глюкозы потребуется для бега с такими затратами, если 50 мин в его организме идет полное окисление глюкозы, а 10 мин – гликолиз?
Решение:
Х = 240 × 180 : 80 = 540 (г)
У = 25 × 50 × 180 : 1520= 142 (г)
3) 540 + 142 = 682 (г)
Ответ: 682 г.
Слайд 27
По горизонтали.
1. Совокупность внешних и внутренних признаков организма.
2. Место расположения гена в хромосоме. 3. Общее свойство
всех организмов приобретать новые признаки в пределах вида. 4. Особь, в генотипе которой находятся одинаковые аллели одного гена. 5. Наука о наследственности и изменчивости. 6. Особь, в генотипе которой находятся разные аллели одного гена. 7. Объекты, с которыми проводил свои опыты Т.Морган. 8. Гены, обеспечивающие развитие альтернативных признаков. 9. Совокупность генов, полученная организмом от родителей. 10. Основоположник генетики.
По вертикали.
11. Общее свойство всех организмов передавать свои признаки потомкам. 12. Одна особь гибридного поколения. 13. Признак, подавляющий другие. 14. Подавляемый признак. 15. Хромосомы, по которым у самцов и самок нет различий.
Кроссворд «Генетические термины»