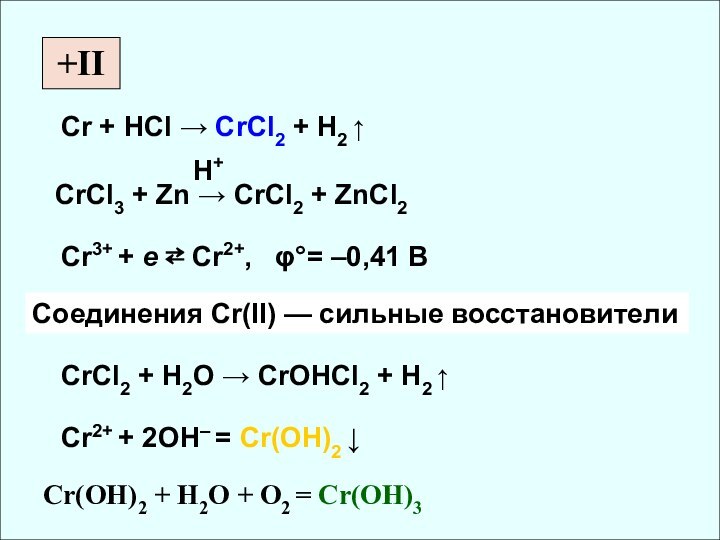
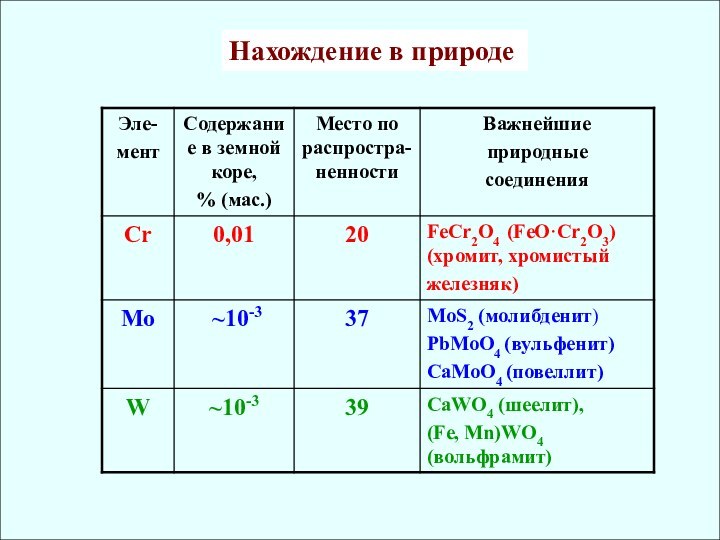
rат, нм
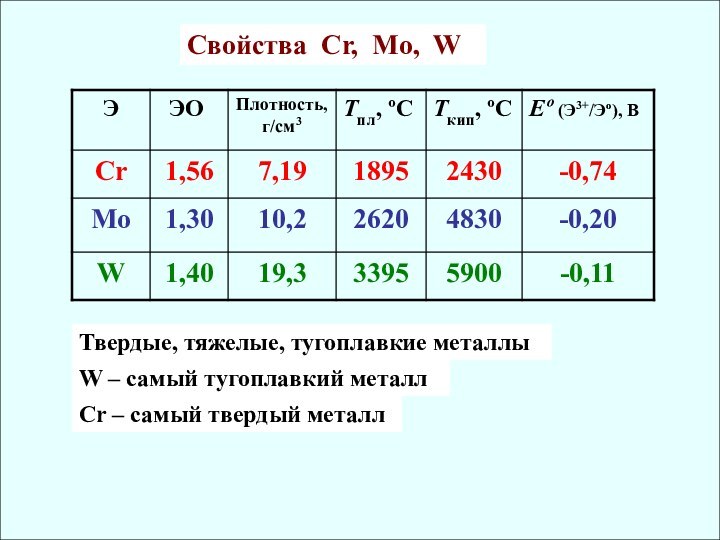
СО Cr [Ar] 3d54s1 0,126 II, III, VI
Mo [Kr] 4d55s1 0,136 (IV, V), VI
W [Xe] 4f145d46s2 0,137 (IV, V), VI
✔ r Mo ≈ r W как следствие лантаноидного сжатия
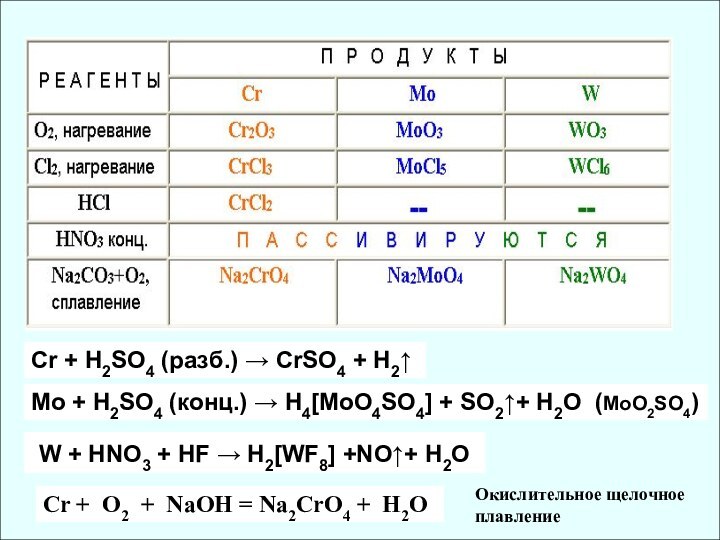
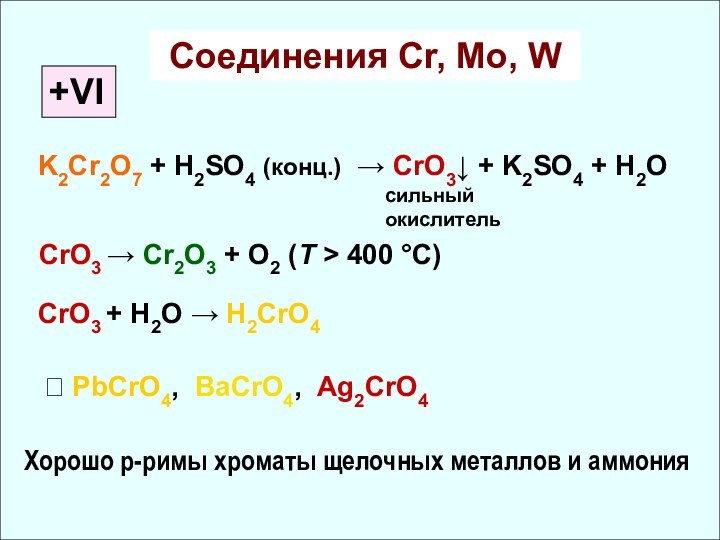
✔ Склонность к проявлению высшей СО растёт
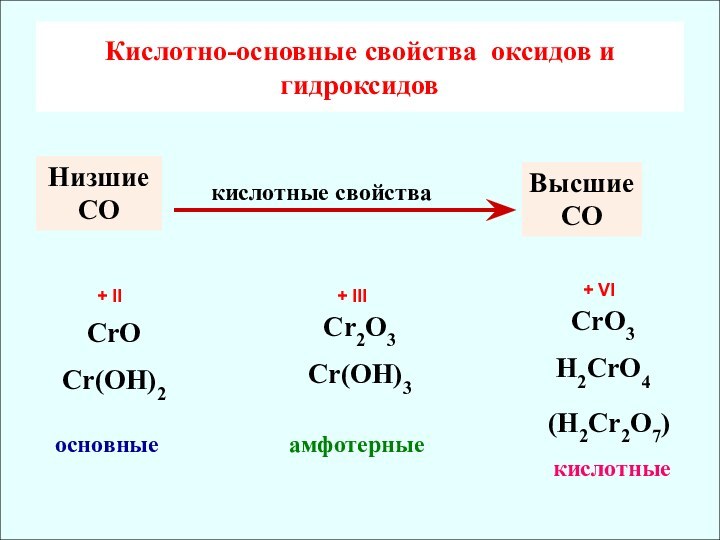
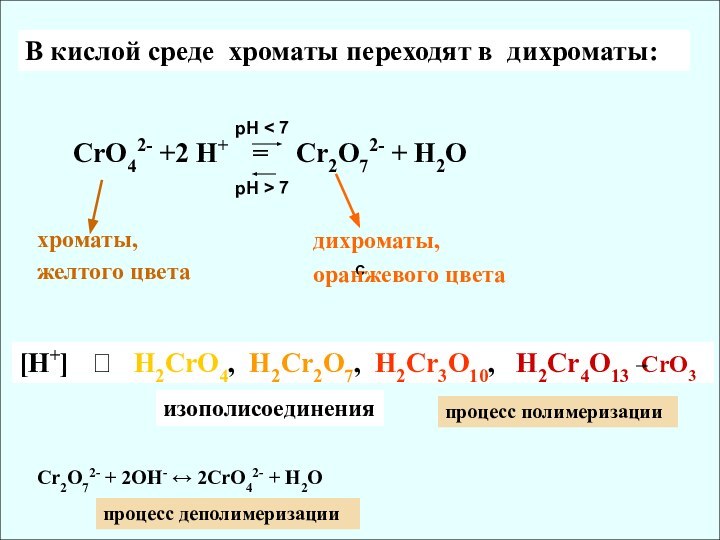
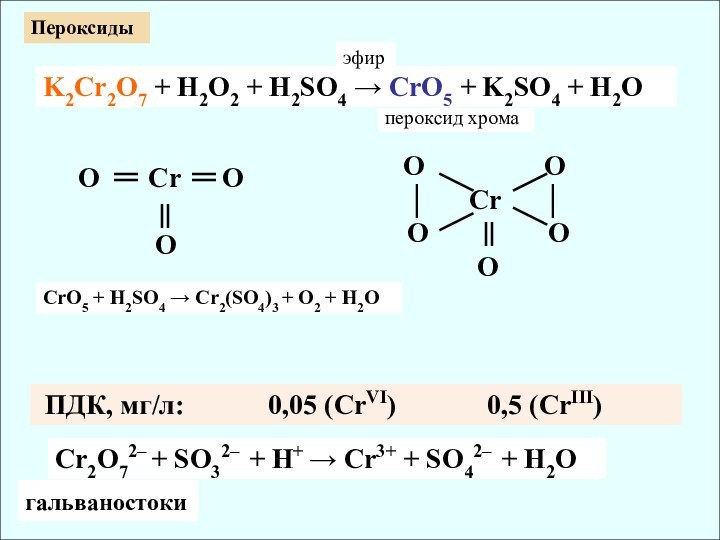
✔ Убывание кислотных свойств (H2CrO4 и H2MoO4)
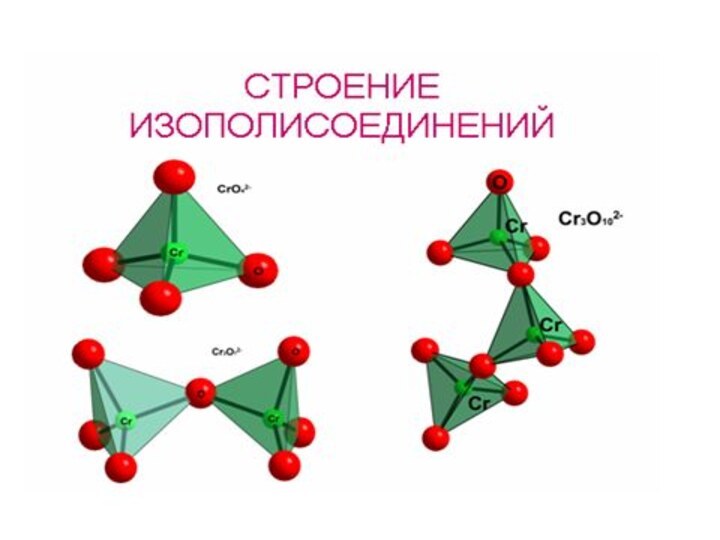
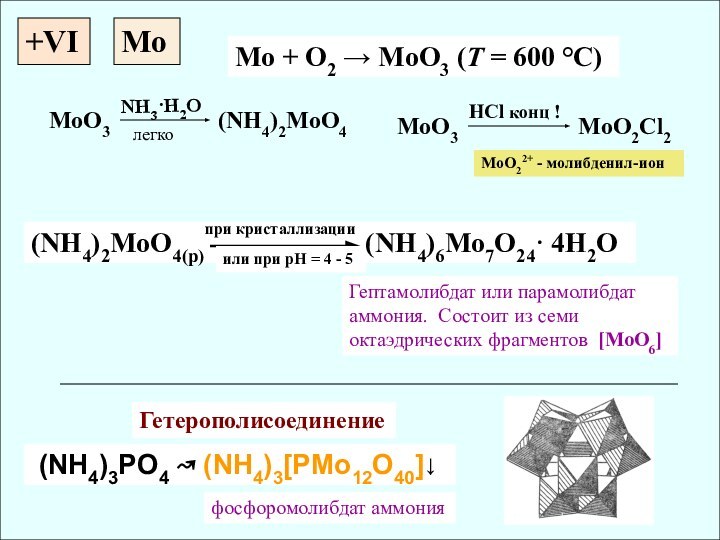
✔ Активные комплексообразователи (изополи- и
гетерополисоединения)


![Химия элементов VIB подгруппы Cr, Mo, W Cr(OH)3 + H2SO4 = Cr2(SO4)3 + H2OCr(OH)3 + NaOH = Na[Cr(OH)4]тетрагидроксохромит натрияCr2O3](/img/tmb/12/1141379/92adaa8b6e3144b3acdb3e42a052c09b-720x.jpg)

![Химия элементов VIB подгруппы Cr, Mo, W Вольфрам. Изополисоединения. [H2W12O42]10-- паравольфрамат Б-ион; [H2W12O40]6-- метавольфрамат-ион[W7O24]6-- паравольфрамат А-ионNa2MoO4 —→ 3MoO3 •](/img/tmb/12/1141379/e50b2f2085eac23a96abf0038ecee8c9-720x.jpg)

![Химия элементов VIB подгруппы Cr, Mo, W [Cr(H2O)6]3+](/img/tmb/12/1141379/499fdb31713ad1c3fe6cd3782baf12f1-720x.jpg)
![Химия элементов VIB подгруппы Cr, Mo, W CrIIICrVICr3+[Cr(OH)6]3-Cr2O72-CrO42-H+H+OH-OH-Схема переходов CrIII в CrVI в различных средах+ восстановитель+ окислитель](/img/tmb/12/1141379/938a1b938677f7f7cf409c7aeeb774f9-720x.jpg)