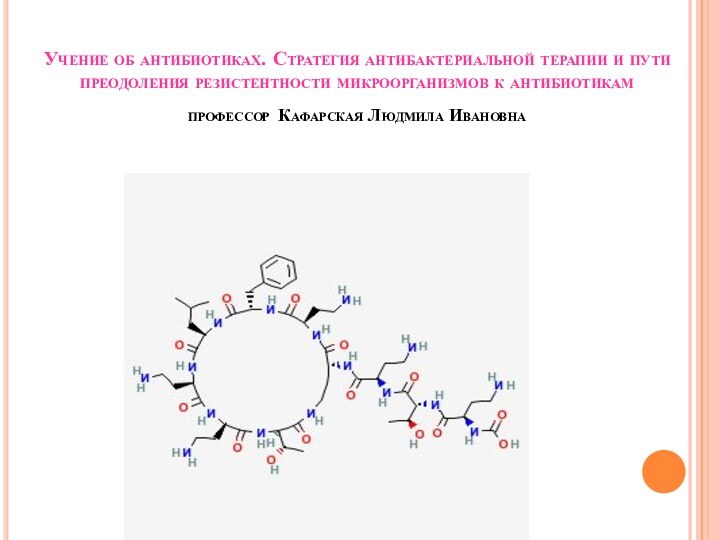
Слайд 2
Современная химиотерапия бактериальных инфекций
В группу антибиотиков объединяют в
настоящее время химиотерапевтические вещества, образуемые при биосинтезе микроорганизмов, их
производные и аналоги, вещества, полученные путем химического синтеза или выделенные из природных источников
(ткани животных и растений), обладающие способностью избирательно подавлять в организме возбудителей заболеваний (бактерии, грибы, простейшие) или задерживать развитие злокачественных новообразований).
Антибиотики могут оказывать иммуномодулирующее действие
Слайд 3
Современная химиотерапия бактериальных инфекций
Антибиотики относятся к наиболее часто
назначае-мым группам лекарственных средств:
100% хирургических больных
70-100% соматических.
В России используется
30 различных групп антибиотиков и около 200 препаратов.
Слайд 4
ИСТОРИЯ ОТКРЫТИЯ АНТИБИОТИКОВ
Александр Флеминг в 1928 году открыл
пенициллин.
Слайд 5
ИСТОРИЯ ОТКРЫТИЯ АНТИБИОТИКОВ
Эрнест Чейн и Говард Вальтер Флори
получили стабильную форму пенициллина в Оксфорде.
1940 год, Э.Чейн –
пенициллин имеет форму В-лактама.
Г.Флори и фирма«Мерк» в США запустили произ-водство пенициллина 1943г
Слайд 6
ИСТОРИЯ ОТКРЫТИЯ АНТИБИОТИКОВ
Эрнест Чейн
Слайд 7
ИСТОРИЯ ОТКРЫТИЯ АНТИБИОТИКОВ
В нашей стране в 1943 году
в промышленное производство пенициллин запущен при активном участии
Ермольевой З.В.
Слайд 8
Современная химиотерапия бактериальных инфекций
Уникальные свойства антибиотиков:
Мишень-рецептор находится не
в тканях человека, а в клетке микроорганизма.
Активность антибиотиков не
является постоянной, а снижается со временем, что обусловлено формированием устойчивости (резистентности).
Резистентность – неизбежное биологическое явление, предотвратить ее практически невозможно.
Антибиотикорезистентность – это опасность не только для пациента, но для многих других людей.
Слайд 9
Генетические аспекты резистентности
Распространение и эволюция генов резистентности –
результат взаимодействия различных генетических структур: хромосом, плазмид, фагов, транслоцирующих
элементов.
Механизмы передачи генов резистентности общие для всех процессов передачи генетической информации.
При трансформации переносятся гены, локализованные как в хромосоме, так и в плазмидах.
Этот процесс имеет значение прежде всего для пневмококков и нейссерий.
Слайд 10
Генетические аспекты резистентности
Роль трансдукции трансдукции ( с помощью
фагов), в природе также ограничена.
Основным способом переноса генов, локализованных
в плазмидах, в пределах одного вида или между родственными видами является конъюгация.
Передача плазмид происходит с высокой частотой, что приводит к распространению штаммов с внехромосомной устойчивостью.
Приобретает характер эпидемии.
Слайд 12
Свойства антибиотиков и требования к ним.
Высокая биологическая активность
по отношению к чувствительным микроорганизмам.
Избирательность действия - активность
в отношении отдельных групп микроорганизмов.
Требования :
Максимальная терапевтическая эффективность при минимальной концентрации в организме человека.
Максимальное действие при минимальной токсичности.
Стабильность при широких диапазонах рН(per os).
Не вызывать аллергических реакций у хозяина
Не воздействовать на нормальную микрофлору
Слайд 13
Классификация антибиотиков
По происхождению:
Природные:
Из собственно бактерий (грамицидин с)
Из актиномицетов
(стрептомицин)
Из грибов и лишайников (пенициллин, цефалоспорины).
Полусинтетические – продукты модификации
молекул:
Оксациллин, ампициллин и др.
Синтетические :
Сульфаниламиды
Хлорамфеникол – природный, но получают синетичесим путем
Слайд 14
Классификация антибиотиков
По спектру антимикробной активности:
Антибактериальные
Противогрибковые
Антипротозойные
По типу взаимодействия:
Бактериостатические –
ингибируют рост, но не вызывают гибели бактерий, клетки сохраняют
способность к росту (макролиды).
Бактерицидные – убивают бактериальную клетку (аминогликозиды, пенициллины,цефалоспорины).
Слайд 15
Классификация антибиотиков по механизму действия
Ингибиторы синтеза клеточной стенки.
Ингибиторы
синтеза белка на рибосомах.
Ингибиторы синтеза нуклеиновых кислот
Нарушающие функцию мембран
клетки
Слайд 16
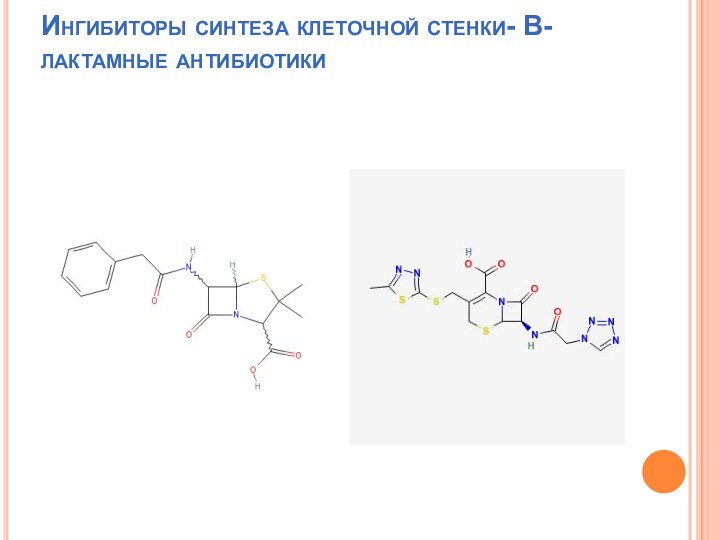
Ингибиторы синтеза клеточной стенки- В-лактамные антибиотики
Слайд 17
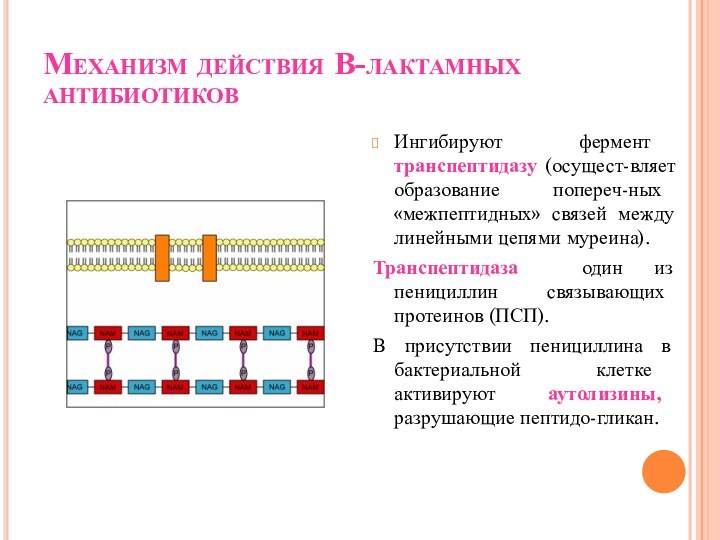
Механизм действия В-лактамных антибиотиков
Ингибируют фермент транспептидазу (осущест-вляет образование
попереч-ных «межпептидных» связей между линейными цепями муреина).
Транспептидаза один
из пенициллин связывающих протеинов (ПСП).
В присутствии пенициллина в бактериальной клетке активируют аутолизины, разрушающие пептидо-гликан.
Слайд 18
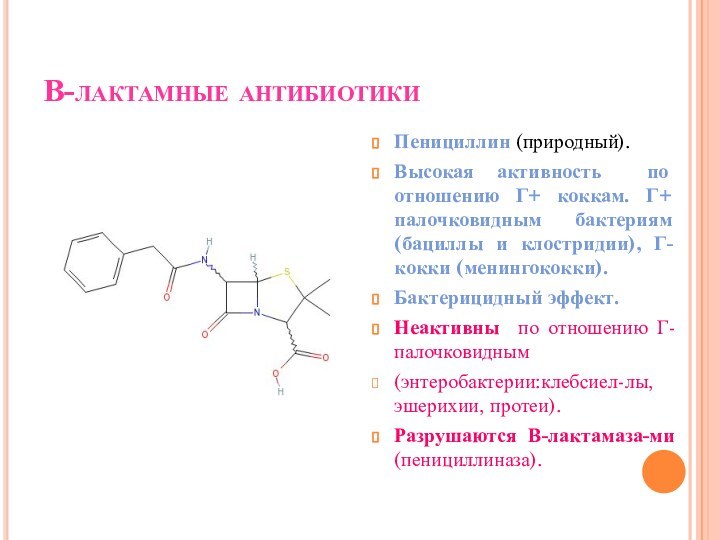
В-лактамные антибиотики
Пенициллин (природный).
Высокая активность по отношению Г+
коккам. Г+ палочковидным бактериям (бациллы и клостридии), Г- кокки
(менингококки).
Бактерицидный эффект.
Неактивны по отношению Г- палочковидным
(энтеробактерии:клебсиел-лы, эшерихии, протеи).
Разрушаются В-лактамаза-ми (пенициллиназа).
Слайд 19
Механизмы возникновения резистентности
Продукция ферментов:
разрушающих антибиотик, таких как B-лактамазы
(разрушают В-лактамное кольцо).
Модифицирующих антибиотик
(добавляются новые хими-ческие группы, которые
инактивируют антибиотик).
Слайд 20
Механизмы возникновения резистентности
Изменение структуры мишени транспептидазы (ПСП)– антибиотик
не может связаться с мишенью и возникает резистентность ко
всем В-лактамным анти-биотикам (MRSA).
Слайд 21
Механизмы возникновения резистентности
Изменение проницаемости
клеточных мембран.
Слайд 22
Механизмы возникновения резистентности
Изменение структуры транспортных систем.
Слайд 23
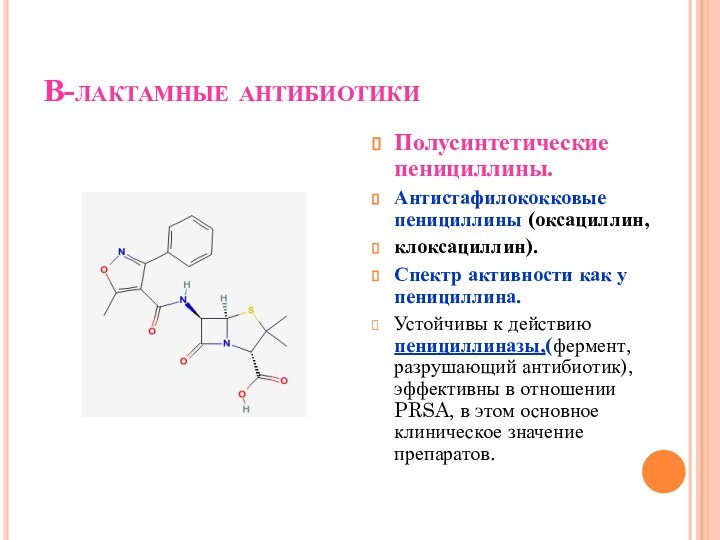
В-лактамные антибиотики
Полусинтетические пенициллины.
Антистафилококковые пенициллины (оксациллин,
клоксациллин).
Спектр активности как у
пенициллина.
Устойчивы к действию пенициллиназы,(фермент, разрушающий антибиотик), эффективны в отношении
PRSA, в этом основное клиническое значение препаратов.
Слайд 24
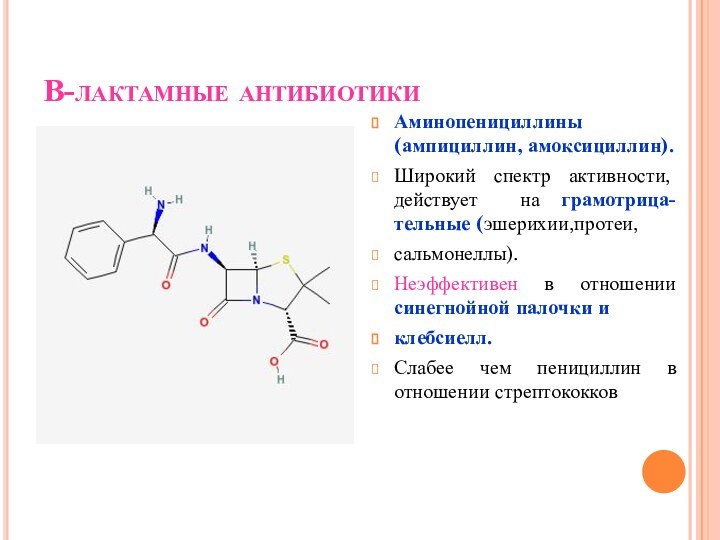
В-лактамные антибиотики
Аминопенициллины (ампициллин, амоксициллин).
Широкий спектр активности, действует на
грамотрица-тельные (эшерихии,протеи,
сальмонеллы).
Неэффективен в отношении синегнойной палочки и
клебсиелл.
Слабее чем пенициллин
в отношении стрептококков
Слайд 25
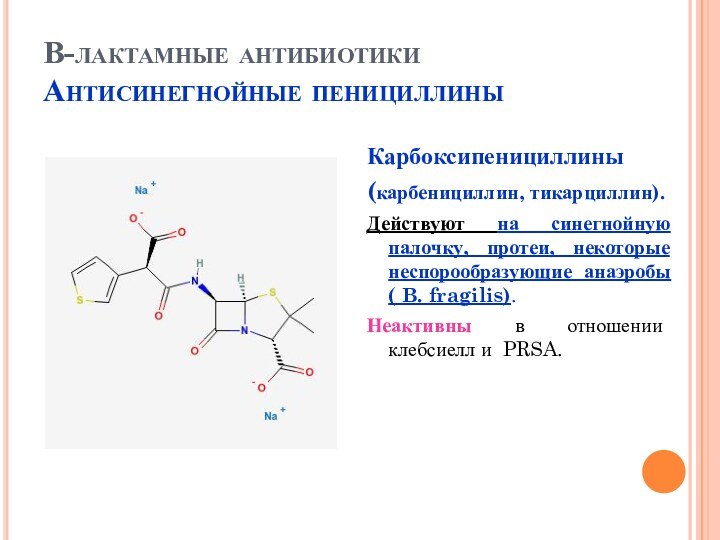
В-лактамные антибиотики
Антисинегнойные пенициллины
Карбоксипенициллины
(карбенициллин, тикарциллин).
Действуют на синегнойную палочку, протеи,
некоторые неспорообразующие анаэробы ( B. fragilis).
Неактивны в отношении клебсиелл
и PRSA.
Слайд 26
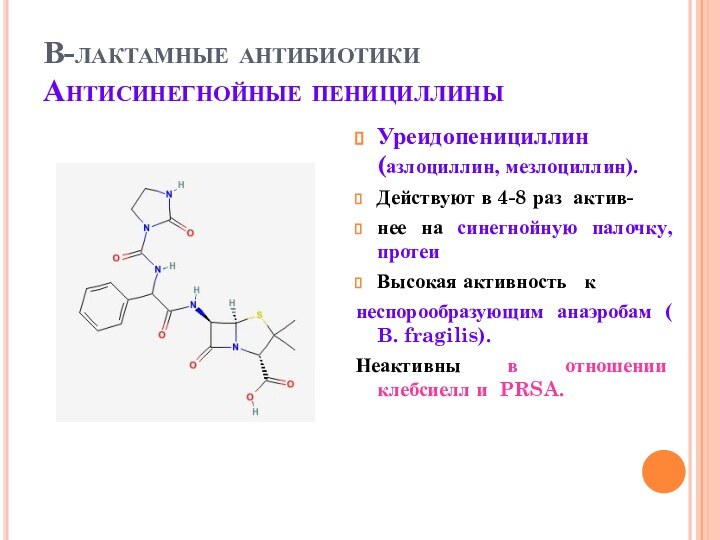
В-лактамные антибиотики
Антисинегнойные пенициллины
Уреидопенициллин (азлоциллин, мезлоциллин).
Действуют в 4-8 раз
актив-
нее на синегнойную палочку, протеи
Высокая активность к
неспорообразующим анаэробам
( B. fragilis).
Неактивны в отношении клебсиелл и PRSA.
Слайд 27
В-лактамные
структурно близкие пенициллинам соединения
Карбапенемы
(имипенем, мерапенем)
Широкий спектр активности
в отношении всех клинически значимых микроорганизмов, включая проблемные (синегнойная
палочка, энтерококк, неспорообразующие анаэробы).
Неактивны в отношении MRSA.
Антибиотики резерва, назначаются при тяжелых инфекциях, вызванных множественно устойчивыми микроорганизмами
Ингибируют в-лактамазы.
Слайд 28
В-лактамы моноциклические
Монобактамы (азтреонам, тазобактам).
Выраженный бактерицидный эффект в отношении
грамотрицательных, микроорга-низмов, устойчивы к действию В-лактамаз.
Создание этих препаратов –
пример
преодоления резистентности, вызванной ферментами.
Слайд 29
Защищенные пенициллины
Состоят из 2-х компонентов: В-лактамный
антибиотик и
ингибитор в-лактамаз (клавулановая кислота, сульбактам, тазобактам).
Аугментин (амоксициллин + клавулановая
кислота).
Широкий спектр активности.
Неактивны в отношении MRSA.
Антибиотики резерва.
Слайд 30
В-лактамные антибиотики
цефалоспорины
Общие свойства цефа-лоспоринов:
Выраженный бактерицидный эффект.
Низкая токсичность.
Широкий терапевтический
диапазон.
Синергизм с аминоглико-зидами.
Не действуют на энтеро-кокки,MRSA.
Слайд 31
В- лактамные антибиотики
цефалоспорины
I поколение цефалоспоринов:
Цефазолин, цефалотин,цефамезин.
Спектр активности :
Активны
в отношении грамположительных микроорганизмов.
Умеренная активность в отношении грамотрицательных.
Не действует
на синегнойную палочку, серрации.
энтерококки,MRSA.
Устойчивы к стафилококковым В-лактамазам.
Слайд 32
В- лактамные антибиотики
цефалоспорины
II поколение цефалоспоринов6
Цефамандол, цефуроксим, цефаклор, цефметазол.
По
спектру активности в отношении грамположительных бактерий аналогичны цефалоспоринам I
поколения.
Более активны по отношению к грамотрицательным бактериям
(клебсиеллы, эшерихии,сальмонеллы).
Не действует на синегнойную палочку, серрации. энтерококки,MRSA.
Слайд 33
В- лактамные антибиотики
цефалоспорины
III поколение цефалоспоринов: цефотаксим (клафоран), цефтазидим
(фортум).
Высокая активность в отношении грамотрицательных бактерий (включая госпитальные штаммы).
Активность
в отношении синегнойной палочки.
Избирательная (цефтазидим) антианаэробная ( B. fragilis). активность.
В отношении грамположительных кокков активность ниже, чем у цефалоспоринов I – II поколений
Не действуют на энтерококки,MRSA.
Применяются для лечения тяжелых форм инфекций.
Слайд 34
В- лактамные антибиотики
цефалоспорины
IV поколение цефалоспоринов:
Цефпирон, цефитим.
Широкий спектр активности
в отношении всех клинически значимых микроорганизмов, включая проблемные (синегнойная
палочка, энтерококк, неспорообразующие анаэробы).
Не действуют на энтерококки,MRSA.
Устойчивы к действию В-лактамаз.
Слайд 35
Побочные действия В-лактамных антибиотиков.
Ампициллин, пенициллин – аллергические реакции.
Ампициллин,
в меньшей степени цефалоспорины – дисбактериоз.
Очень высокие дозы пенициллина
нейротоксический
эффект.
Слайд 36
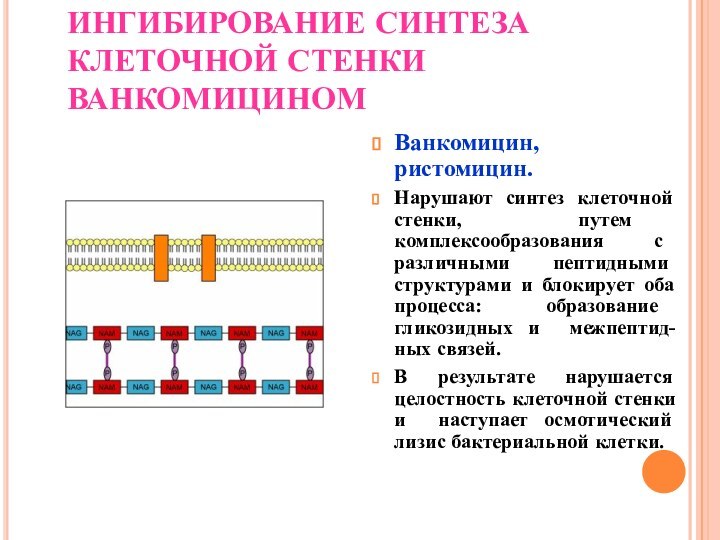
ИНГИБИРОВАНИЕ СИНТЕЗА КЛЕТОЧНОЙ СТЕНКИ ВАНКОМИЦИНОМ
Ванкомицин, ристомицин.
Нарушают синтез клеточной
стенки, путем комплексообразования с различными пептидными структурами и блокирует
оба процесса: образование гликозидных и межпептид-ных связей.
В результате нарушается целостность клеточной стенки и наступает осмотический лизис бактериальной клетки.
Слайд 37
Гликопептидные антибиотики
Ванкомицин активен в отношении большинства грамположительных кокков,
включая MRSA.
Не действует на грамотрицательные бактерии и микобактерии.
Препарат выбора
для лечения инфекций, вызванных MRSA и энтерококками.
Токсичен (ототоксичность, нефротоксичен, флебиты).
Слайд 38
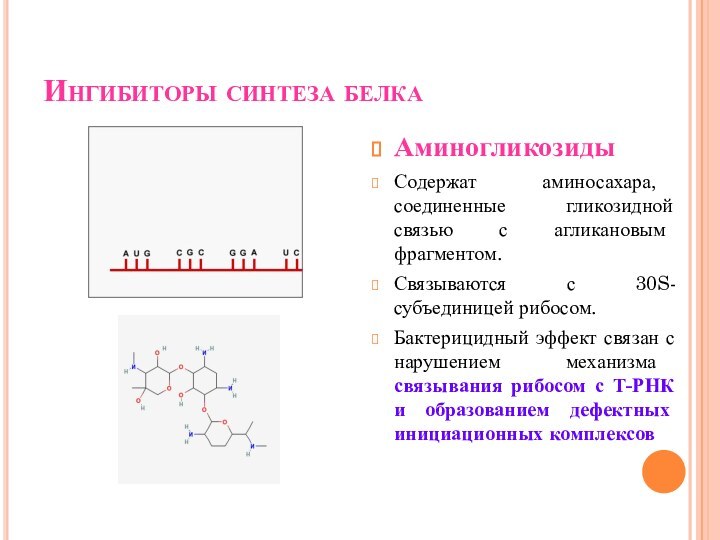
Ингибиторы синтеза белка
Аминогликозиды
Содержат аминосахара, соединенные гликозидной связью с
агликановым фрагментом.
Связываются с 30S-субъединицей рибосом.
Бактерицидный эффект связан с нарушением
механизма связывания рибосом с Т-РНК и образованием дефектных инициационных комплексов
Слайд 39
Ингибиторы синтеза белка
Аминогликозиды
I поколение – стрептомицин, канамицин, мономицин.
Активны
в отношении грамотрицательных бактерий и микобактерий, возбудителей туберкулеза, бруцеллеза.
II
поколение – гентамицин, тобрамицин.
Активны в отношении грамотрицательных бактерий, включая синегнойную палочку, энтеробактеры, серрации.Грамположительные кокки.
III поколение –амикацин, нетилмицин
Активны в отношении грамотрицательных бактерий, включая синегнойную палочку, энтеробактеры, серрации.
Устойчивы к ферментам, инактивирующими другие аминогликозиды. Грамположительные кокки.
Слайд 40
Ингибиторы синтеза белка
Аминогликозиды- побочные действия.
Нефротоксический эффект – нарушения
функции почек ( выражен у гентамицина).
Ототоксичность – повреждения слухового
нерва ( стрептомицин).
Нарушается передача импульса в нервно-мышечном аппарате (курареподобный эффект).
Слайд 41
Механизм резистентности к аминогликозидам
Важнейший механизм – ферментативный.
Добавляются новые
химические группы, которые инактивируют антибиотик.
Метилирование
Ацетилирование
Фосфорилирование
Слайд 42
Ингибиторы синтеза белка
Макролиды в структуре содержат макроциклическое лактонное
кольцо, связанное с углеводными остатками.
Природные :
эритромицин,
олеанодомицин, рокситромицин
Полусинтетические
Азитромицин
Кларитромицин
Слайд 43
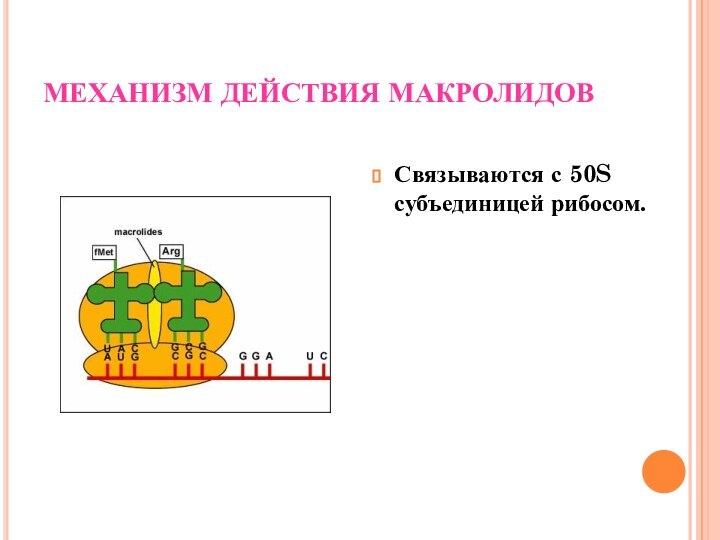
МЕХАНИЗМ ДЕЙСТВИЯ МАКРОЛИДОВ
Связываются с 50S субъединицей рибосом.
Слайд 44
Ингибиторы синтеза белка
Общие свойства макролидов:
Бактеристатическое действие.
Преимущественная активность против
грамположительных кокков (стрептококки, стафилококки).
Активность против хламидий, микоплазм. риккетсий.
Неактивны в
отношении грамотрицательных бактерий.
Очень низкая токсичность.
Усиливают перистальтику кишечника
Слайд 45
Ингибиторы синтеза белка
Производное эритромицина азитромицин (азалиды).
Обладает уникальной способностью
накапливаться внутри эукариотической клетки и во внесосудистом русле.Концентрация в
тканях в 100 раз выше, чем в сыворотке.
Более активны в отношении грамотрицательных бактерий, включая H.influensa, N. gonorrhoeae.
Препарат выбора для лечения инфекций, передающихся половым путем и инфекций верхних дыхательных путей.
Слайд 46
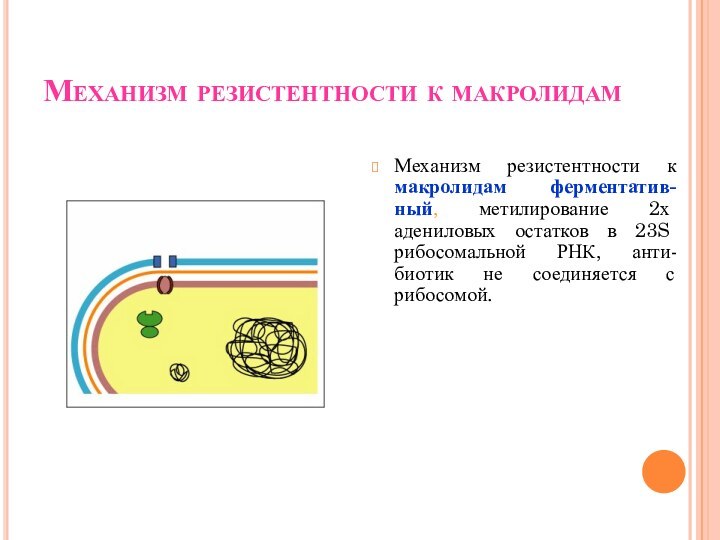
Механизм резистентности к макролидам
Механизм резистентности к макролидам ферментатив-ный,
метилирование 2х адениловых остатков в 23S рибосомальной РНК, анти-биотик
не соединяется с рибосомой.
Слайд 47
Ингибиторы синтеза белка
Линкомицин и клин-дамицин.
Связываются с 50S субъединицей
По
антимикробному действию близки к макролидам.
Активны а отношении грамположительных кокков
Некоторых
грамположительных палочек, микоплазм.
Выражена антианаэробная активность
Не действуют на грамотрицательные.
Слайд 48
Ингибиторы синтеза белка
Линкомицин и клиндамицин.
Накапливается в костной ткани.
Иммуномодуляторы.
Побочные
эффекты – псевдомембранозный
колит, что связано с избыточным размножением Closridium
difficile.
Слайд 49
Псевдомембранозный колит
Побочные эффекты псевдомембранозный
колит.
Связано с избыточным размножением Closridium
difficile.
2 токсина
Энтеротоксин
Цитотоксин
Возникает диарея, воспаление.
Лечение ванкомицином
Слайд 50
Ингибиторы синтеза белка
Тетрациклины (доксациклин) связываются с 30S субъединицей,
воздействует и на 70S млекопитающих.
Широкий спектр активности: Г+, Г-,
хламидии, риккетсии, бруцеллы, йерсинии.
Новое поколение-глилцилциклин.
Слайд 51
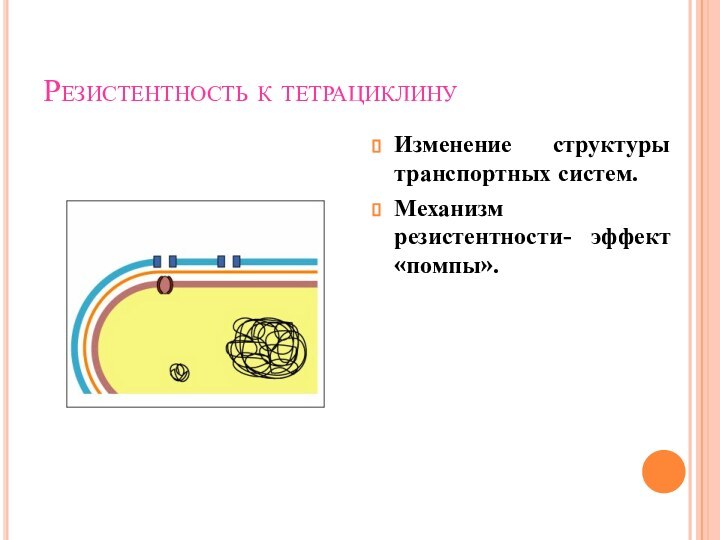
Резистентность к тетрациклину
Изменение структуры транспортных систем.
Механизм резистентности- эффект
«помпы».
Слайд 52
Ингибиторы синтеза белка
Побочные эффекты тетрациклинов.
«Черные зубы у детей».Откладываются
в костной ткани.
Фотосенсибилизация.
ЖКТ – рвота натощак.
Слайд 53
Ингибиторы синтеза белка
Оксазолидины
Линезолид - новое поколение антибиотиков.
Слайд 54
Ингибиторы синтеза белка
Линезолид новая группа антибиотиков.
Связывается с 23S
рибосомальной РНК в 50 Sсубъединице рибосом.
Активен в отношении ванкомицин-резистентных
энтерококков метициллин-резистентных стафилококков, пенициллин-резистентных пневмококков.
Бактерицидный эффект в отношении пневмококков.
Бактериостатический по отношению энтерококков и метициллин-резистентных стафилококков.
Слайд 55
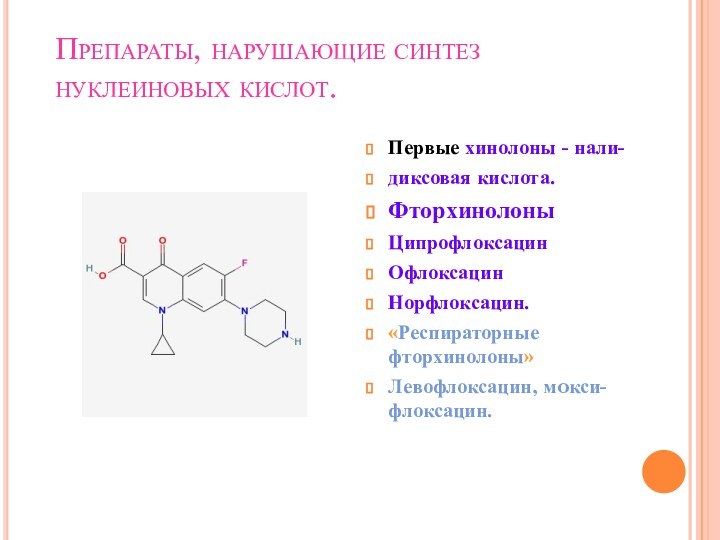
Препараты, нарушающие синтез нуклеиновых кислот.
Первые хинолоны - нали-
диксовая
кислота.
Фторхинолоны
Ципрофлоксацин
Офлоксацин
Норфлоксацин.
«Респираторные фторхинолоны»
Левофлоксацин, мoкси-флоксацин.
Слайд 56
Механизм действия фторхинолонов
Ингибируют фермент –
ДНК-гиразу, бактериальную) нарушается суперспирализация
ДНК.
Бактериальная клетка не может осуществлять репликацию ДНК
Слайд 57
Механизм резистентности к фторхинолонов
Изменение структуры-мишени ДНК-гиразы и топоизомеразы
Слайд 58
Препараты, нарушающие синтез нуклеиновых кислот
Рифампицин –нарушает синтез бактериальной
РНК, блокируя фермент фермент РНК полимеразу.
Активны в отношении
M.tuberculosis,
N.meningitidis,
H.influenzae.
Окрашивает при выведении в оранжевый цвет мочу, слюну.
Слайд 59
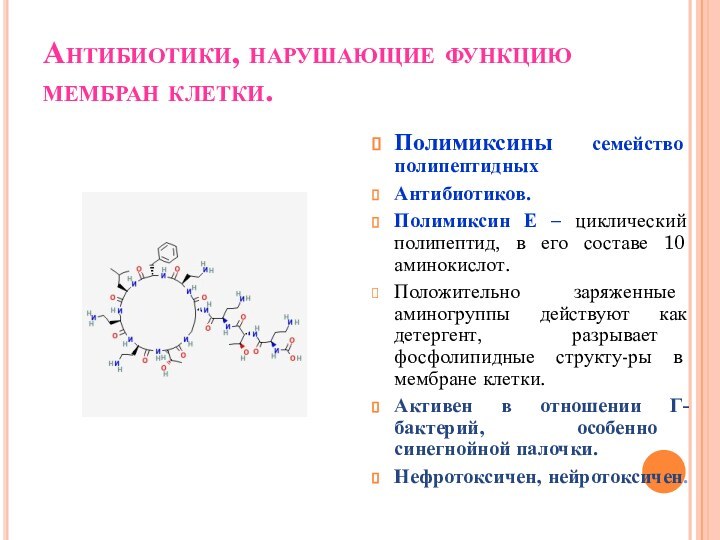
Антибиотики, нарушающие функцию мембран клетки.
Полимиксины семейство полипептидных
Антибиотиков.
Полимиксин Е
– циклический полипептид, в его составе 10 аминокислот.
Положительно заряженные
аминогруппы действуют как детергент, разрывает фосфолипидные структу-ры в мембране клетки.
Активен в отношении Г- бактерий, особенно синегнойной палочки.
Нефротоксичен, нейротоксичен.
Слайд 60
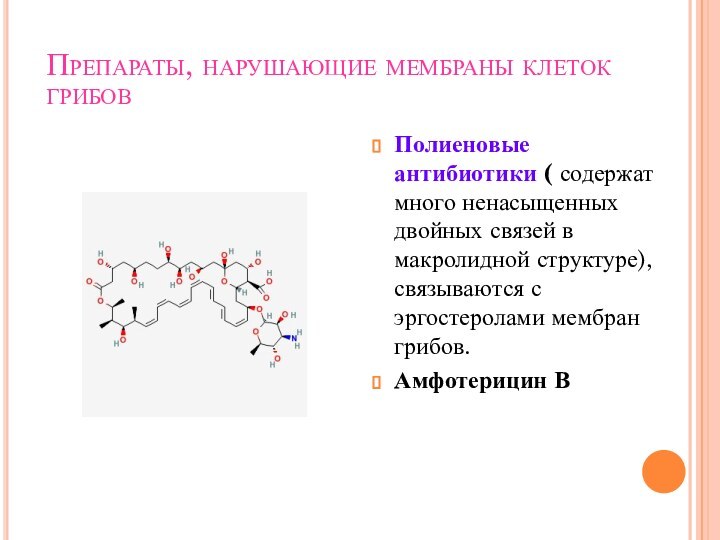
Антибиотики, нарушающие функцию мембран клетки.
Липопептидные антибиотики-новый класс мембраноактивных
антибиотиков.
Даптомицин – бактерицидная активность в отношении резистентных Г+ кокков
(энтерококков, метициллин-резистентных стафилококков. Вызывает деполяризацию
Цитоплазматическойю
Резистентность редкою
Токсичны