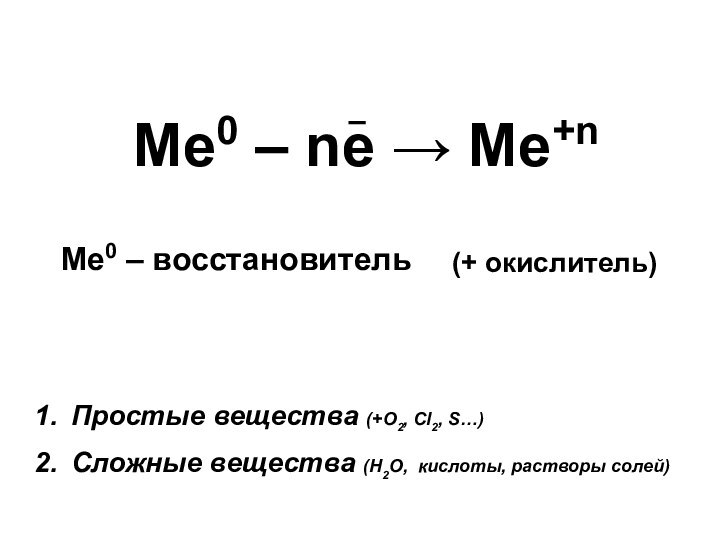атомы металла связаны металлической связью.
Валентные электроны металлов прочно связаны
с ядром.У металлов, стоящих в главных подгруппах (А), на внешнем уровне обычно 2 электрона.
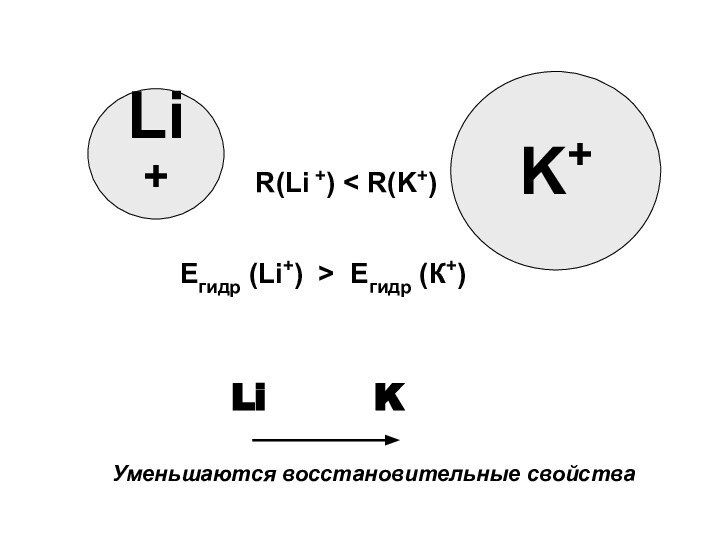
В группе сверху вниз происходит увеличение восстановительных свойств металлов.
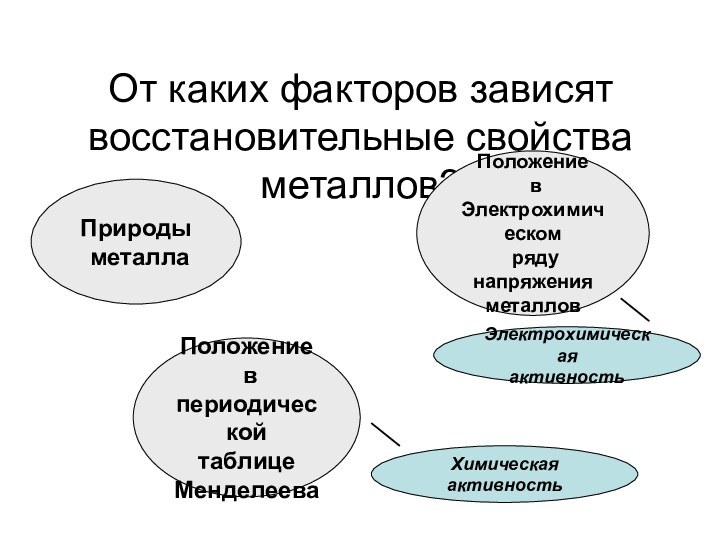
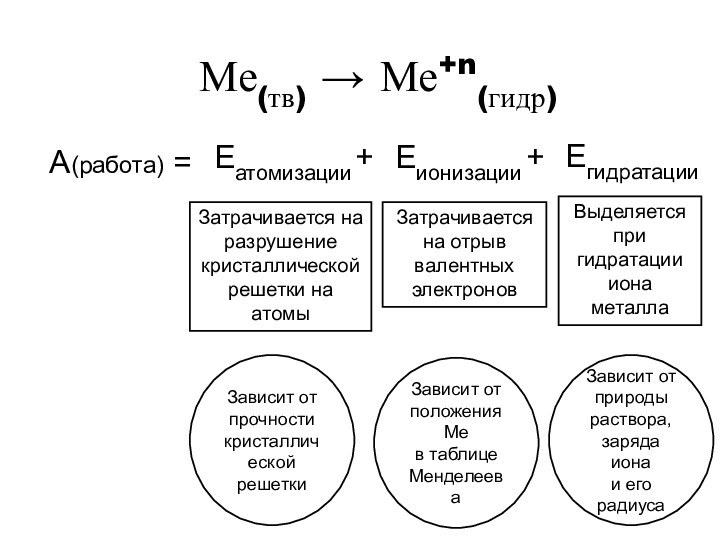
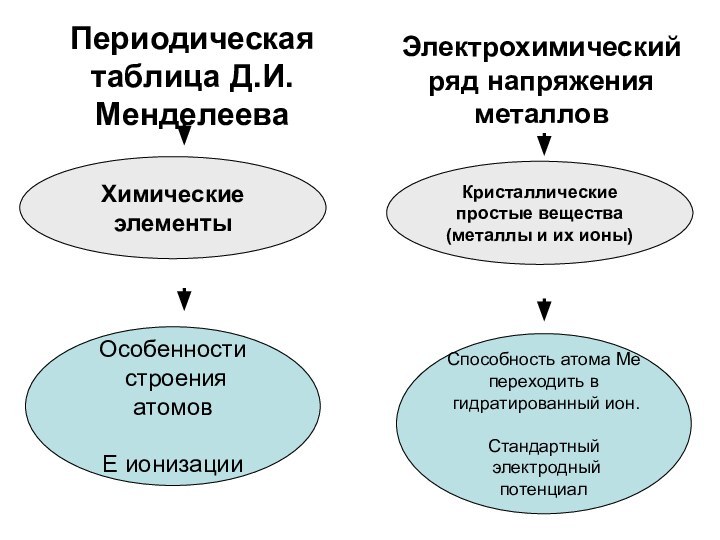
Чтобы оценить реакционную способность металла в растворах солей и кислот, достаточно посмотреть в электрохимический ряд напряжения металлов.
7. Чтобы оценить реакционную способность металла в растворах солей и кислот, достаточно посмотреть в периодическую таблицу Д.И.Менделеева.