- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Изотопы
Содержание
- 2. Ti, Zr, Hf, Rf (Th)Радиоактивные изотопы, Звара
- 4. Природа сходства Zr и Hf (лантанидное сжатие)Устойчивость
- 6. Природные формы, получениеTi (0.6 %), 10-й элемент
- 7. Природные формы, получениеZr (0.02%), 21-й элемент по распространенности ZrSiO4 – цирконZrO2 – бадделит
- 8. Природные формы, получениеHf (4·10-4 %, сопутствует Zr),
- 9. TiO2 + 2C + 2Cl2 → TiCl4
- 10. Производство 105/тЗапасы 5· 108/т-+Графит, анодTiO2РасплавCaCl2C или Ti
- 11. Ti открыт в рутиле 200 лет назад
- 12. Механические свойства Ti чистого и загрязненного (Ti
- 13. Ti легкий конструкционный материал ( в 3-5
- 14. Химические свойстваВосстановители, пассивацияС водородом МНх (обратимость, аккумуляторы, 1 г Ti → 2 л Н2)
- 15. с кислородом ЭО2 – фианиты
- 16. BaTiO3 – Вул, сагнетоэлектрик – спонтанная ассиметрия
- 17. M + N2 → MN
- 18. M + 2Г2 → МГ4МО2 + 2Г2
- 19. Фотокатализ (нанопроволока TiO2)Гидротермальная обработка геля TiO2·nH2O (T = 110 – 250 ºC; t = 20 ч)h+e-Ti4+OH
- 20. Фотонный кристалл TiO2
- 21. Мезопористая структура на основе анодированного титана
- 22. НаноолимпиадаС 12 апреля 2008 г.Сайт www.nanometer.ruКонкурс эмблем
- 23. МГ4 – бесцветные, твердые вещества (исключение TiCl4)Молекулярные
- 24. 3 TiCl4 + 4H2O → 2H2TiCl6 + Ti(OH)4[TiCl6]2-+H2O→[TiCl5(H2O)]1- H2O[TiCl4(H2O)2] 2H2O [TiCl2(H2O)4]2+ →[Ti(OH)Cl2(H2O)3]1+ →→ [Ti(OH)4(H2O)2]
- 25. H2OOHOHOHOHH2OTiH2OH2OOHOHOHOHTi-2H2OH2OHOOHTiTiH2OOHOHOHOHOHOH
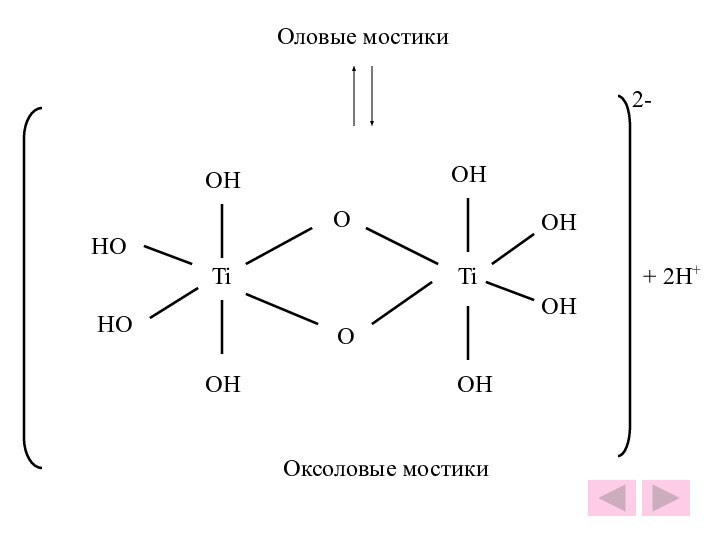
- 26. Оловые мостики+ 2H+2-TiTiOHOHOHOHOOOHOHHOHOОксоловые мостики
- 27. Э4+ + H2O = ЭО2+ + 2H+Солеобразующий
- 28. Соединения М (+3)2TiOSO4 + Zn + 2H2SO4
- 29. Ti + TiO2 = “TiO”Ti3O, Ti6O –
- 30. Дробная кристаллизацияЭкстрация трибутилфосфатом (ТБФ)Из нитратных растворов ZrO(NO3)2· xH2OФракционная дистилляция
- 36. Скачать презентацию
- 37. Похожие презентации
Ti, Zr, Hf, Rf (Th)Радиоактивные изотопы, Звара – отделение Rf от Ac Ti, Zr, Hf с большим периодом полураспада от 1015 до 1017 лет























![Изотопы 3 TiCl4 + 4H2O → 2H2TiCl6 + Ti(OH)4[TiCl6]2-+H2O→[TiCl5(H2O)]1- H2O[TiCl4(H2O)2] 2H2O [TiCl2(H2O)4]2+ →[Ti(OH)Cl2(H2O)3]1+ →→ [Ti(OH)4(H2O)2]](/img/tmb/14/1317234/7652f4b8fc34f73abda243bd419c564d-720x.jpg)


![Изотопы Соединения М (+3)2TiOSO4 + Zn + 2H2SO4 = Ti2(SO4)3 + ZnSO4 +2H2O[Ti(H2O)6]3+[Ti(H2O)6]3+](/img/tmb/14/1317234/25fdba2c8897117efe61784126c4ec6f-720x.jpg)







Слайд 4
Природа сходства Zr и Hf (лантанидное сжатие)
Устойчивость высших
степеней окисления
Ti Zr Hf TiO, Ti2O3, TiO2, но только ZrO2, HfO2
TiF2, TiF3, TiF4, но только ZrF4, HfF4
Координационные числа у Ti (6, реже 4),
у Zr и Hf (6, 7, 8, 9)
Слайд 6
Природные формы, получение
Ti (0.6 %), 10-й элемент по
распространенности (7-ой среди металлов)
FeTiO3 – ильменит
TiO2 – рутил, анатаз,
брукитCaTiO3 – перовскит
Слайд 7
Природные формы, получение
Zr (0.02%), 21-й элемент по распространенности
ZrSiO4 – циркон
ZrO2 – бадделит
Слайд 8
Природные формы, получение
Hf (4·10-4 %, сопутствует Zr), 52-й
элемент по распространенности
Th (2·10-3 %), 232Th имеет период полураспада
~ 14 млрд летСлайд 9 TiO2 + 2C + 2Cl2 → TiCl4 +
2CO
Дистилляция TiCl4 (283ºC) – FeCl3 (317 ºC)
TiCl4 + 2Mg
900º 2MgCl2 + Ti (тоже Zr и Hf)K2[ZrF6] + 4Na → 4NaF + 2KF + Zr (тоже Hf)
MI4 1000ºC 400 ºC M + 2I2 (очень чистый)
ХТР
Слайд 10
Производство 105/т
Запасы 5· 108/т
-
+
Графит, анод
TiO2
Расплав
CaCl2
C или Ti тигель
(катод)
Chen (Nature)
TiO2 + 2Ca2+ + 4e- → Ti +
2CaO4Cl- - 4e- → 2Cl2
Слайд 11
Ti открыт в рутиле 200 лет назад Клапротом
Zr
открыт более 150 лет назад в цирконе
Hf – открыт
75 лет назад, X-ray спектрыZr – малое сечение захвата нейтронов
ТВЭЛы, контейнеры для U
Hf – большое сечение захвата нейтронов
Слайд 12 Механические свойства Ti чистого и загрязненного (Ti –
роза и лопата)
Удельный вес Ti
→ Zr → Hf4.5 г/см3 6.5 г/см3 13.2 г/см3
Коррозийная стойкость, немагнитность
E (Э4+/Э), В -1.17 -1.53 -1.70
α Ti 882 ºС β Ti ( тоже для Zr и Hf)
ГПУ ОЦК
Слайд 13
Ti
легкий конструкционный материал ( в 3-5
раз прочнее Al и Mg)
ферротитан ( 0,1% Ti
к стали - эластичность)Ti – Al сплавы (интерметаллиды TiAl и TiAl3)
подлодки – немагнитность (коррозия 20 мкм за 1000 лет)
NiTi – nitinol – NiTi Navel Ordnance Lab.
Zr
сплавы, отражатель нейтронов
Hf
поглотитель нейтронов
Слайд 14
Химические свойства
Восстановители, пассивация
С водородом МНх (обратимость, аккумуляторы, 1
г Ti → 2 л Н2)
Слайд 15
с кислородом ЭО2 – фианиты
TiO2 ZrO2 HfO2 ThO2
ΔΗf кДж/моль 944 1080 1136 1190
Tпл, ºС 1825 2680 2812 3050
Химическая инертность, Ti – белила, не взаимодействуют с H2O, HNO3(р), NaOH(р)
МО2 + КОН (К2СО3) сплав К2МО3
К2TiO3 + H2O → TiO2·H2O + KOH
Слайд 16 BaTiO3 – Вул, сагнетоэлектрик – спонтанная ассиметрия структуры
перовскита
PbTiO3 – PbZrO3 – ЦТС
“smart”, “intelligent” materials
Пьезо-, пироэлектрики
BaZrO3, BaHfO3,
BaThO3Слайд 17 M + N2 → MN
“TiN” ~ Au (коронки)
—
MO2 + 6HF → H2[ЭF6] +
2H2OMO2 + 3 H2C2O4 → H2[M(C2O4)3] + 2H2O
или
M + 6HF → H2[ЭF6] + 2H2↑
M + 3 H2C2O4 → H2[M(C2O4)3] + 3H2O
Слайд 18
M + 2Г2 → МГ4
МО2 + 2Г2 =
МГ4 + О2 (ΔG>0)
2C + О2 = 2СО (ΔG
<< 0)МО2 + 2С + 2Сl2 → MCl4 + 2CO (ΔG<0)
Слайд 19
Фотокатализ (нанопроволока TiO2)
Гидротермальная обработка геля TiO2·nH2O (T =
110 – 250 ºC; t = 20 ч)
h+
e-
Ti4+
OH
Слайд 23
МГ4 – бесцветные, твердые вещества (исключение TiCl4)
Молекулярные решетки
TiCl4 ZrCl4 HfCl4 ThCl4
tпл ºC -23 437 432 770Устойчивость в парах, КЧ = 4, ковалентная связь, в кристаллическом состоянии – бесконечные цепи октаэдров ЭХ6
π – связывание: вакантные d-АО металла + неподеленные электронные пары галогена
Катализаторы Циглера – Натта (гигроскопичность)
TiCl4 + H2O → TiO2· nH2O + HCl
аэрозоль
Слайд 24
3 TiCl4 + 4H2O → 2H2TiCl6 + Ti(OH)4
[TiCl6]2-+H2O→[TiCl5(H2O)]1-
H2O
[TiCl4(H2O)2] 2H2O [TiCl2(H2O)4]2+ →
[Ti(OH)Cl2(H2O)3]1+ →
→ [Ti(OH)4(H2O)2]
Слайд 27
Э4+ + H2O = ЭО2+ + 2H+
Солеобразующий характер
МОГ2, МО(NO3)2
Соли титанила, цирконила
TiOCl2, ZrOBr2
TiOSO4 + H2O2 + H2SO4
= H2[TiO2(SO4)3] + H2Oпероксотитанил ион
Слайд 28
Соединения М (+3)
2TiOSO4 + Zn + 2H2SO4 =
Ti2(SO4)3 + ZnSO4 +2H2O
[Ti(H2O)6]3+
[Ti(H2O)6]3+ Δ =
17·103 см-1 сиреневый[TiCl6]3- Δ = 21·103 см-1 фиолетовый
Ti2(SO4)3 + KMnO4 + H2O → Ti(OH)2SO4 + K2SO4 + MnSO4 + H2SO4
Слайд 29
Ti + TiO2 = “TiO”
Ti3O, Ti6O – связи
М-М кластеры
Для Zr, а тем более для Hf –
не характерны низшие степени окисления“TiO” → Ti1-хO TiO1+y
от Ti0.9O до TiO0.9





























