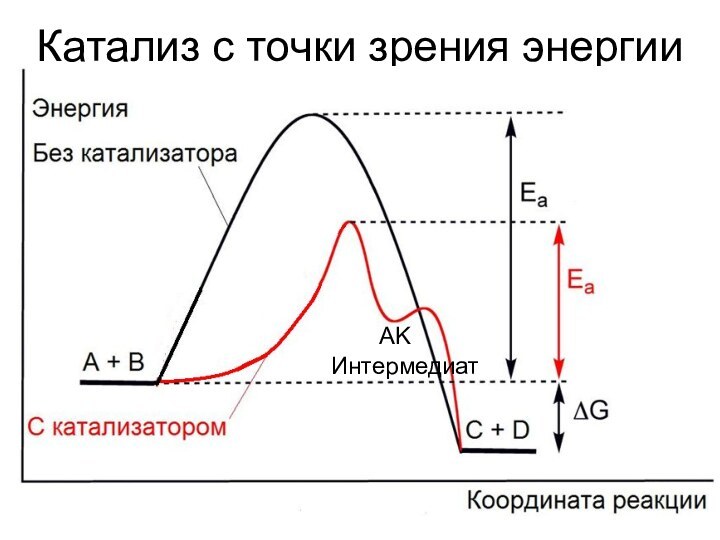
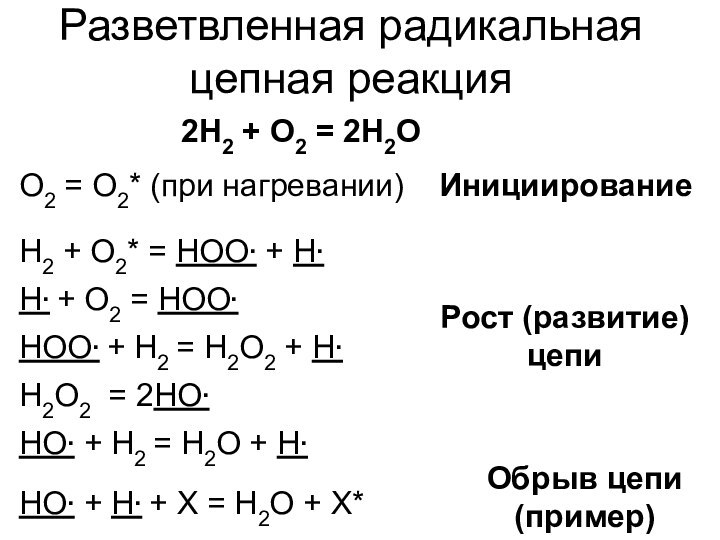
само при этом не расходующееся
***Это не значит, что катализатор
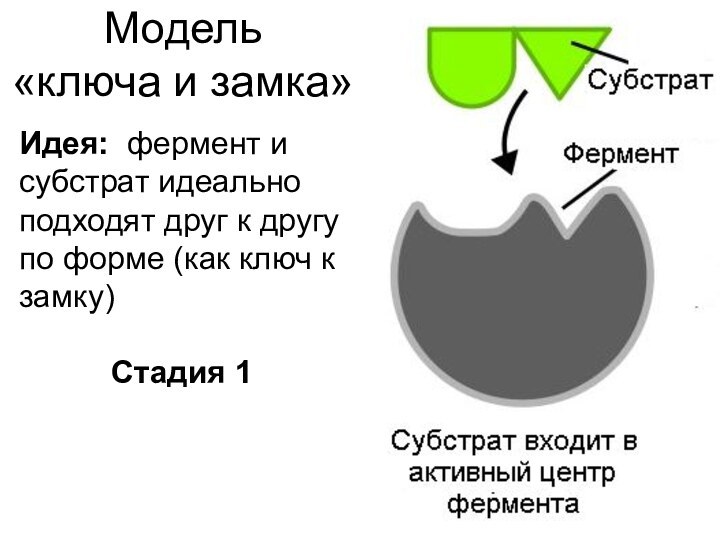
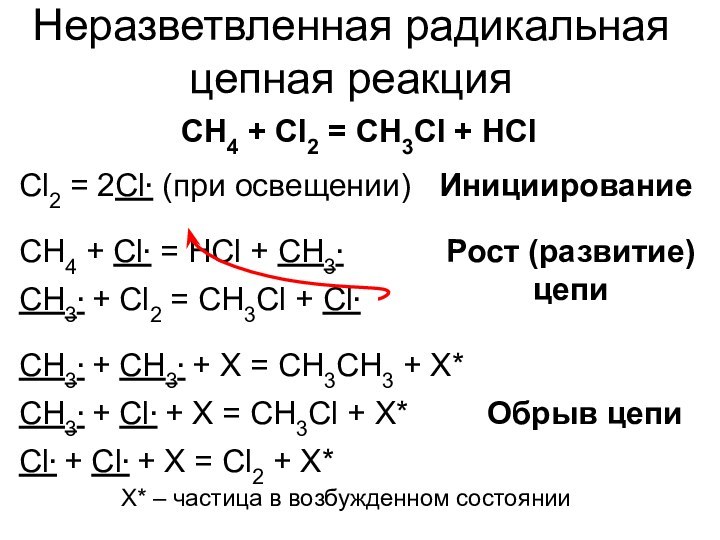
не участвует в реакции!*** Участвует, и еще как! Кроме положительного катализа (ускорение), существует отрицательный (ингибирование)
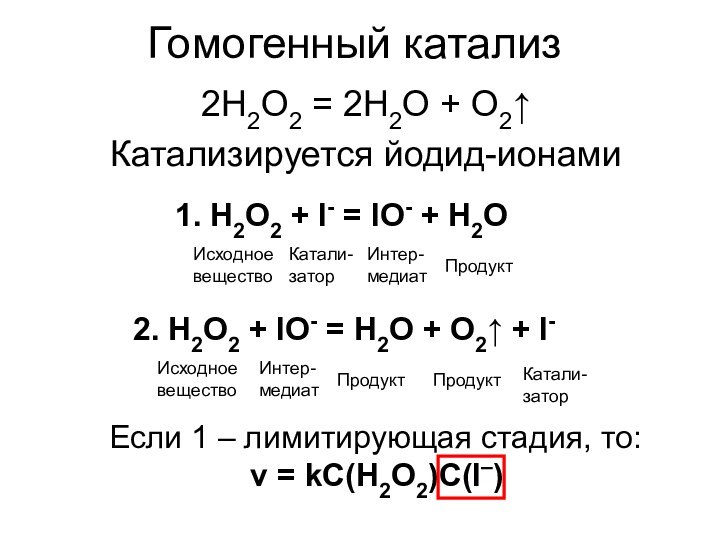
Катализ бывает гомогенный (катализатор в одной фазе с реагентами) и гетерогенный (катализатор и реагенты в разных фазах)