Слайд 2
В живой клетке синтез ферментов не протекает постоянно
с максимальной скоростью – это быстро бы привело к
хаосу.
Скорость образования разных ферментов находиться под жёстким контролем в согласии с потребностями метаболизма и с состоянием развития клетки. Способ функционирования контролирующего аппарата является очень важным в биологическом отношении вопросом, и для его выяснения было проведено много исследований.
Слайд 3
Основной процесс в биосинтетической системе, на который направлен
контроль, - это копирование ДНК (транскрипция) с образованием мРНК.
Это совершенно естественно, так как количество данного фермента, синтезированного рибосомами, прямо зависит от количества мРНК, которая определяет его структуру.
Слайд 4
В каждый данный момент копируется только часть генов,
другие находятся в более или менее покоящемся состоянии, так
как копирование их блокировано. Поскольку продолжительность жизни мРНК в клетках довольно мала (у бактерий она часто составляет минуты, хотя у животных, возможно, день или больше), концентрация мРНК в отсутствии её синтеза вскоре существенно понизится и скорость синтеза кодируемых ею ферментов упадёт. Ингибирование синтеза ферментов по такому механизму известно как РЕПРЕССИЯ.
Слайд 5
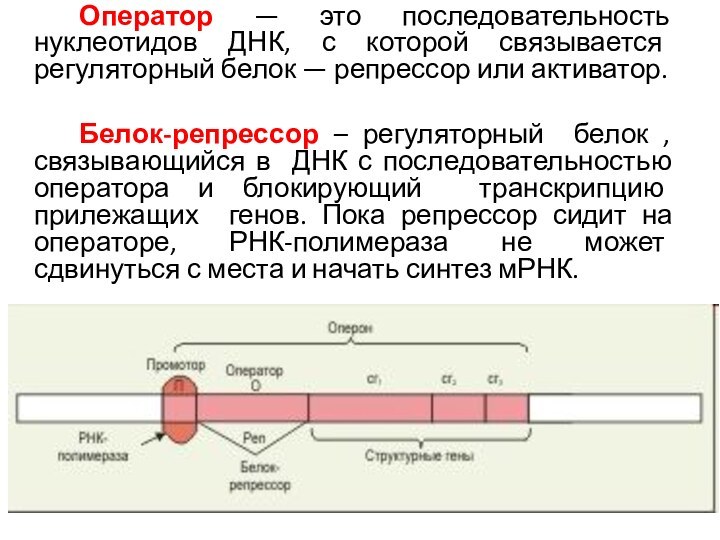
Оператор — это последовательность нуклеотидов ДНК, с которой
связывается регуляторный белок — репрессор или активатор.
Белок-репрессор – регуляторный
белок , связывающийся в ДНК с последовательностью оператора и блокирующий транскрипцию прилежащих генов. Пока репрессор сидит на операторе, РНК-полимераза не может сдвинуться с места и начать синтез мРНК.
Слайд 6
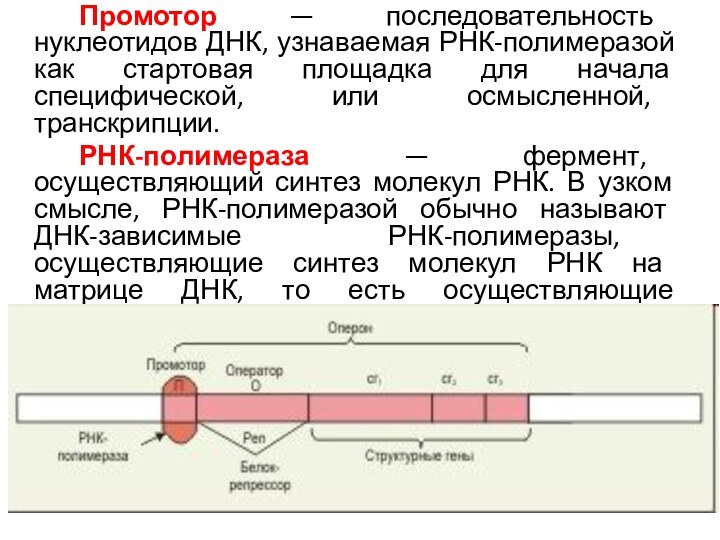
Промотор — последовательность нуклеотидов ДНК, узнаваемая РНК-полимеразой как
стартовая площадка для начала специфической, или осмысленной, транскрипции.
РНК-полимераза
— фермент, осуществляющий синтез молекул РНК. В узком смысле, РНК-полимеразой обычно называют ДНК-зависимые РНК-полимеразы, осуществляющие синтез молекул РНК на матрице ДНК, то есть осуществляющие транскрипцию.
Слайд 7
КОНТРОЛЬ В БАКТЕРИАЛЬНОЙ СИСТЕМЕ
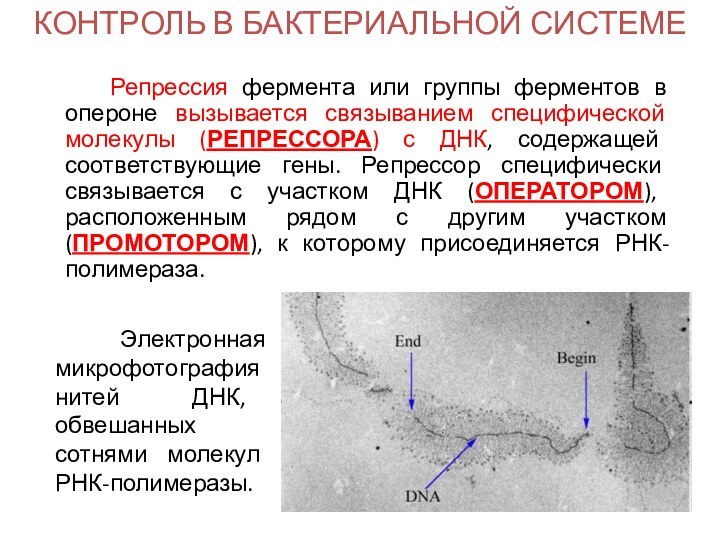
Репрессия фермента или группы ферментов
в опероне вызывается связыванием специфической молекулы (РЕПРЕССОРА) с ДНК,
содержащей соответствующие гены. Репрессор специфически связывается с участком ДНК (ОПЕРАТОРОМ), расположенным рядом с другим участком (ПРОМОТОРОМ), к которому присоединяется РНК-полимераза.
Электронная микрофотография нитей ДНК, обвешанных сотнями молекул РНК-полимеразы.
Слайд 8
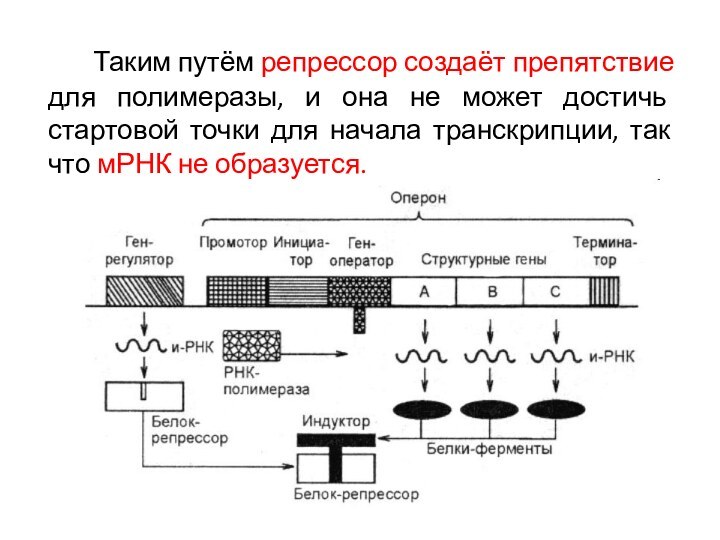
Таким путём репрессор создаёт препятствие для полимеразы, и
она не может достичь стартовой точки для начала транскрипции,
так что мРНК не образуется.
Слайд 9
Наиболее детально исследован lac-оперон у Кишечной палочки (Escherichia
coli).
Он содержит гены, демонстрирующие небольшую группу ферментов, связанных
с утилизацией лактозы.
Слайд 10
Первый из этих ферментов – β- галактозидаза.
В
lac-опероне оператор расположен между промотором и стартовой точкой, и
связавшийся репрессор не позволяет полимеразе пройти участок преинициации и достичь β-галактозидазного гена.
Слайд 11
Было показано, что lac-репрессор связывается только с ДНК,
которая содержит lac-оперон, и только в том месте, в
котором расположен этот оперон. Константа диссоциации образующегося комплекса равна 10-13 М, то есть связывание является очень прочным.
Однако ДНК, несущая мутацию в lac-опероне, обладает низким сродством к lac-репрессору.
Слайд 12
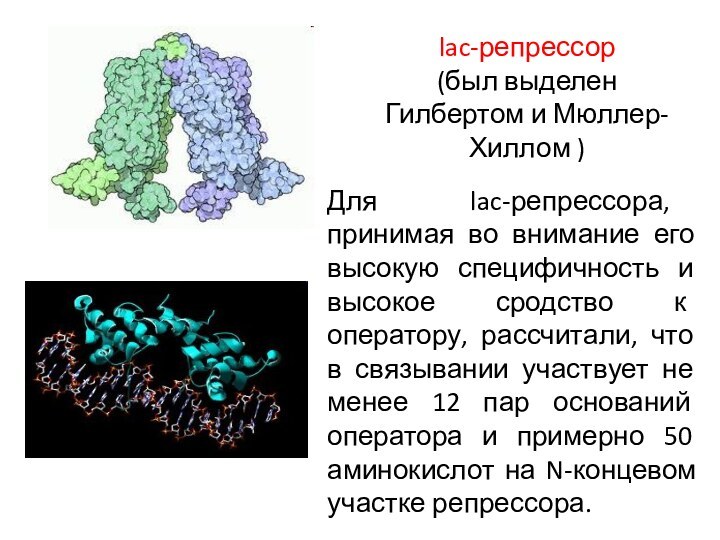
lac-репрессор
(был выделен Гилбертом и Мюллер-Хиллом )
Для lac-репрессора, принимая
во внимание его высокую специфичность и высокое сродство к
оператору, рассчитали, что в связывании участвует не менее 12 пар оснований оператора и примерно 50 аминокислот на N-концевом участке репрессора.
Слайд 13
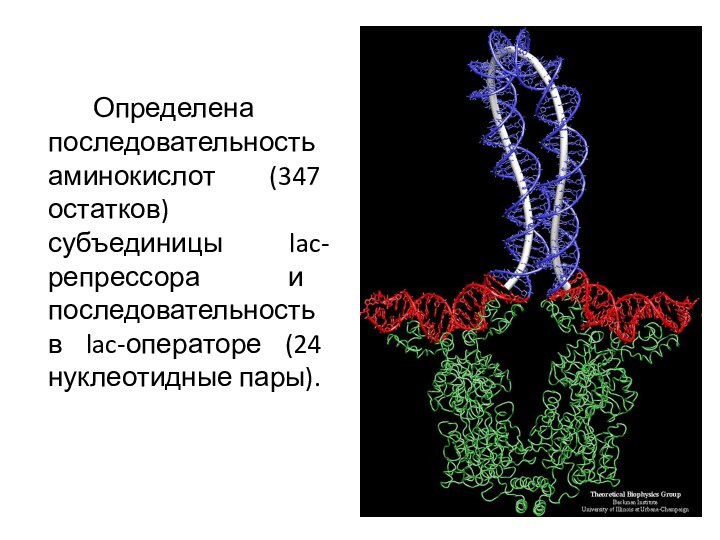
Определена последовательность аминокислот (347 остатков) субъединицы lac-репрессора и
последовательность в lac-операторе (24 нуклеотидные пары).
Слайд 14
Репрессоры, будучи белками, конечно, кодируются определёнными генами в
ДНК.
Интересно, что ген lac-репрессора локализован поблизости от lac-опероне,
но перед lac-промотором, так что образование репрессора не находится под контролем lac-оператора; однако такая локализация не является общей для генов всех репрессоров.
Слайд 15
КОНТРОЛЬ МЕТАБОЛИМИ
Ясно, что синтез ферментов не может быть
все время подавлен, должны существовать какие-то способы освобождения от
репрессии, когда появляется потребность в данном ферменте. В действительности скорость образования ферментов, которая контролируется репрессорами, регулируется состоянием метаболизма в клетке. Эта регуляция осуществляется двумя путями.
Слайд 16
Если имеется дефицит фермента, катализирующего метаболическую реакцию А→В,
то концентрация субстрата А будет слишком высокой;
С другой стороны,
если фермент присутствует в избытке, будет наблюдаться резкое увеличение концентрации продукта В.
Слайд 17
При регуляции первого типа скорость образования фермента контролируется
субстратом, высокая концентрация которого увеличивает скорость образования фермента; при
регуляции второго типа скорость образования контролируется продуктом, высокая концентрация которого снижает скорость образования фермента.
Первый тип регуляции называется индукцией субстратом, а второй – репрессией продуктом.
Слайд 18
Индукция субстратом
Индукция образования отдельных ферментов в присутствии их
субстратов и родственных субстратам веществ является очень важным феноменом,
особенно для бактерий, у которых количество фермента в клетке может увеличиваться в несколько сотен раз при выращивании их в присутствии субстрата.
Примерами этого типа регуляции являются рассмотренные lac- и gal-системы; было проведено множество работ по индукции β-галактозидазы β-галактозидами у E. сoli.
Слайд 19
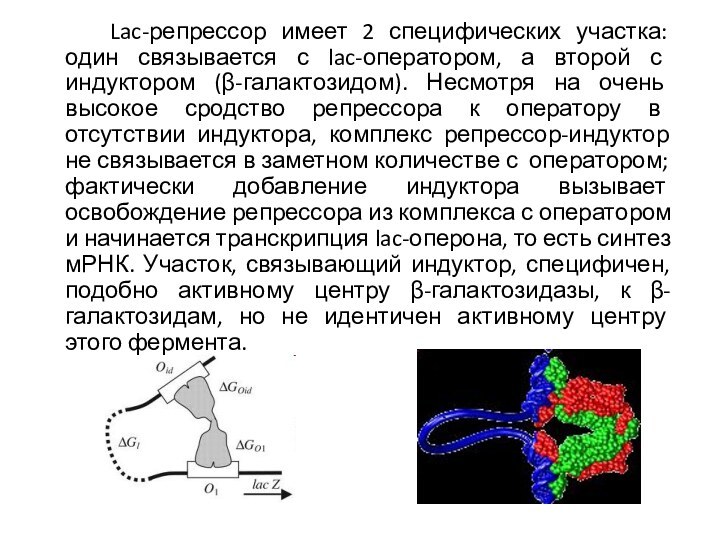
Lac-репрессор имеет 2 специфических участка: один связывается с
lac-оператором, а второй с индуктором (β-галактозидом). Несмотря на очень
высокое сродство репрессора к оператору в отсутствии индуктора, комплекс репрессор-индуктор не связывается в заметном количестве с оператором; фактически добавление индуктора вызывает освобождение репрессора из комплекса с оператором и начинается транскрипция lac-оперона, то есть синтез мРНК. Участок, связывающий индуктор, специфичен, подобно активному центру β-галактозидазы, к β-галактозидам, но не идентичен активному центру этого фермента.
Слайд 20
Например, мелибиоза (α-галактозид) является хорошим индуктором, но плохим
субстратом для фермента; это же относится к IPTC (изопропил-β-тиогалактозиду),
индуктору, который был использован в работе.
Было также показано, что очищенный gal-репрессор останавливает транскрипцию gal-оперона, но этот эффект снимается в присутствии D-галактозы.
Слайд 21
Принимая во внимание все сказанное выше, мы можем
рассматривать индукцию как дерепрессию.
Известен ряд бактериальных мутантов (конститутивные
мутанты), у которых ферменты образуются с одинаковой эффективностью и в присутствии, и в отсутствии индуктора.
Слайд 22
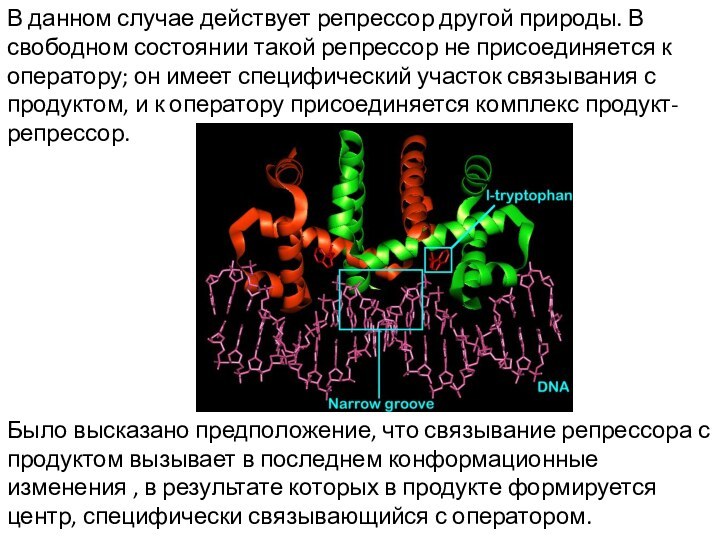
В данном случае действует репрессор другой природы. В
свободном состоянии такой репрессор не присоединяется к оператору; он
имеет специфический участок связывания с продуктом, и к оператору присоединяется комплекс продукт-репрессор.
Было высказано предположение, что связывание репрессора с продуктом вызывает в последнем конформационные изменения , в результате которых в продукте формируется центр, специфически связывающийся с оператором.
Слайд 23
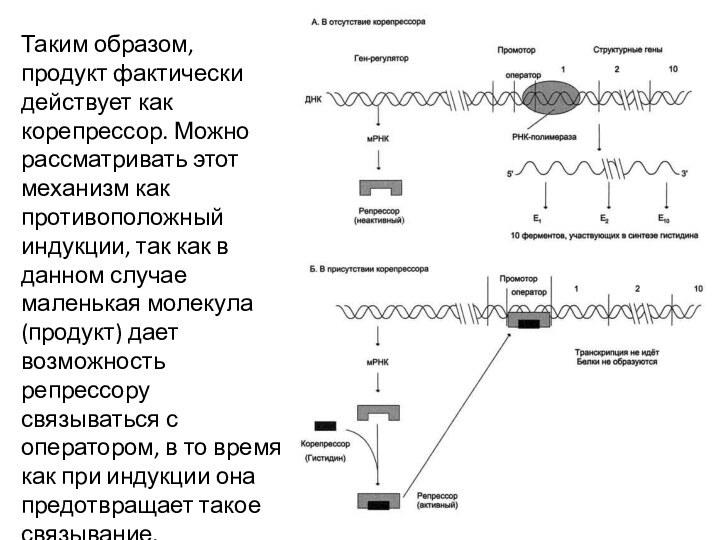
Таким образом, продукт фактически действует как корепрессор. Можно
рассматривать этот механизм как противоположный индукции, так как в
данном случае маленькая молекула(продукт) дает возможность репрессору связываться с оператором, в то время как при индукции она предотвращает такое связывание.
Слайд 24
Большинство исследованных бактериальных систем, репрессируемых продуктами,- это системы,
в которых опероны кодируют синтез определенных аминокислот. Когда бактерии
растут на среде, лишенной аминокислот, они в норме образуют ферменты, необходимые для синтеза аминокислот, которые им требуются.
Слайд 25
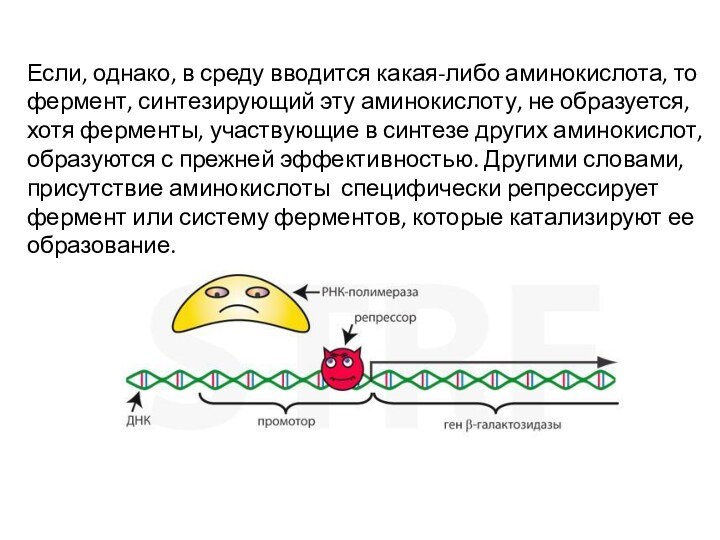
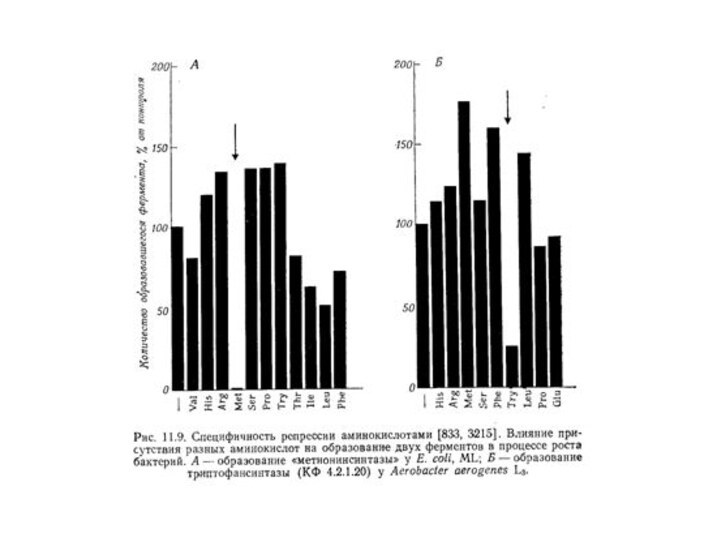
Если, однако, в среду вводится какая-либо аминокислота, то
фермент, синтезирующий эту аминокислоту, не образуется, хотя ферменты, участвующие
в синтезе других аминокислот, образуются с прежней эффективностью. Другими словами, присутствие аминокислоты специфически репрессирует фермент или систему ферментов, которые катализируют ее образование.
Слайд 27
Биосинтез определенных аминокислот из более простых соединений в
большинстве случаев осуществляется в ходе последовательных ферментативных реакций, и
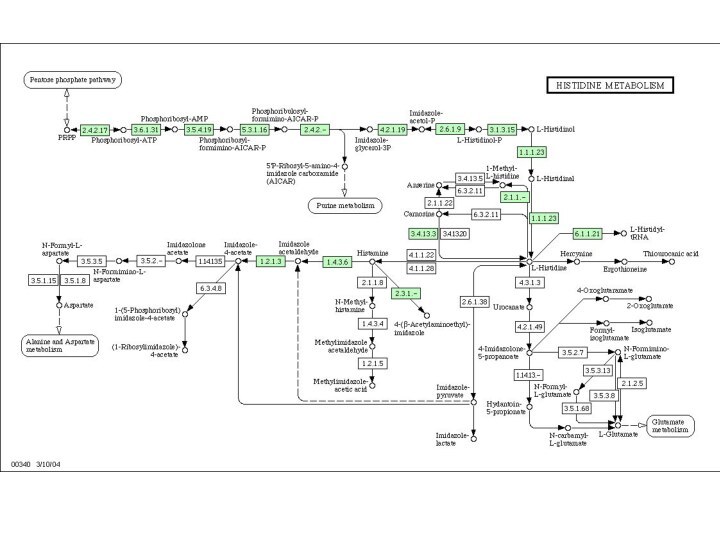
гены, кодирующие синтез соответствующих ферментов, у бактерий обычно сгруппированы в одном опероне. Например, гистидиновый оперон, в котором локализованы гены для ферментов, катализирующих последовательные стадии синтеза гистидина у Salmonella, содержит гены для десяти ферментов, каждый из которых катализирует одну из реакций, ведущих к образованию гистидина.
Слайд 29
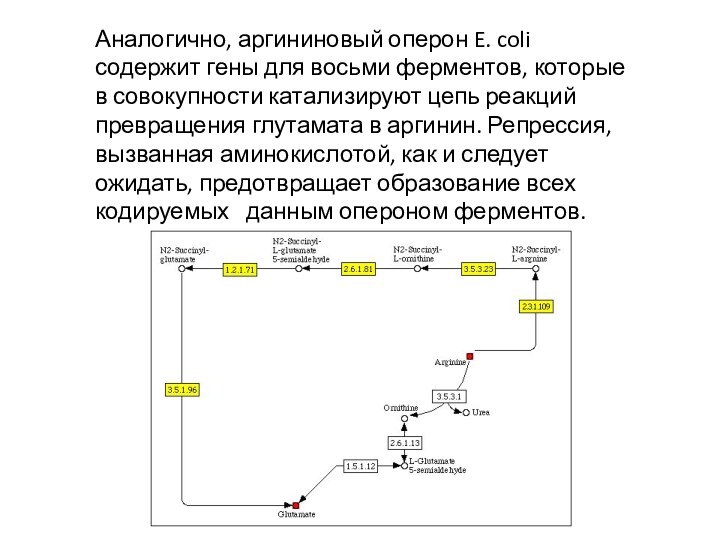
Аналогично, аргининовый оперон E. coli содержит гены для
восьми ферментов, которые в совокупности катализируют цепь реакций превращения
глутамата в аргинин. Репрессия, вызванная аминокислотой, как и следует ожидать, предотвращает образование всех кодируемых данным опероном ферментов.
Слайд 30
При репрессии продуктом (аминокислотой) истинные репрессоры отличаются по
своей природе от тех репрессоров, которые функционируют в системе
индукции субстратом. Проведенные недавно исследования привели к интересным предположениям, основанным, с одной стороны, на анализе свойств участвующих в репрессии молекул, а с другой- на генетических данных. Имеются сведения о том, что активные репрессоры представляют собой комплексы, состоящие из белка и низкомолекулярной РНК, похожей на молекулу тРНК, которая в свою очередь находится в комплексе с соответствующей аминокислотой. Очень высокая специфичность к аминокислоте (разной в каждом отдельном случае) соответствует специфичности аминоацил-тРНК- синтетаз к своим субстратам.
Слайд 31
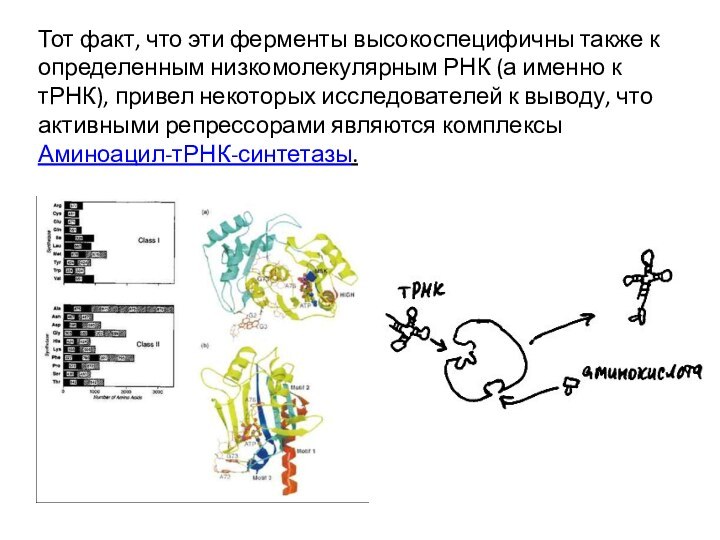
Тот факт, что эти ферменты высокоспецифичны также к
определенным низкомолекулярным РНК (а именно к тРНК), привел некоторых
исследователей к выводу, что активными репрессорами являются комплексы Аминоацил-тРНК-синтетазы.
Слайд 32
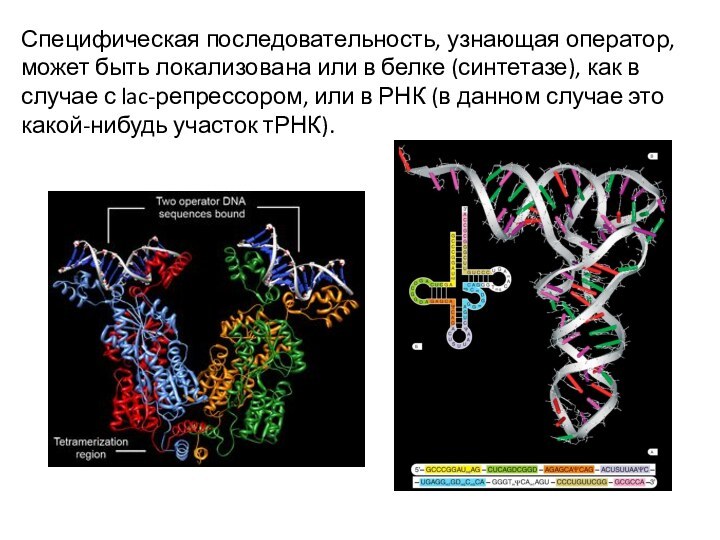
Специфическая последовательность, узнающая оператор, может быть локализована или
в белке (синтетазе), как в случае с lac-репрессором, или
в РНК (в данном случае это какой-нибудь участок тРНК).
Слайд 33
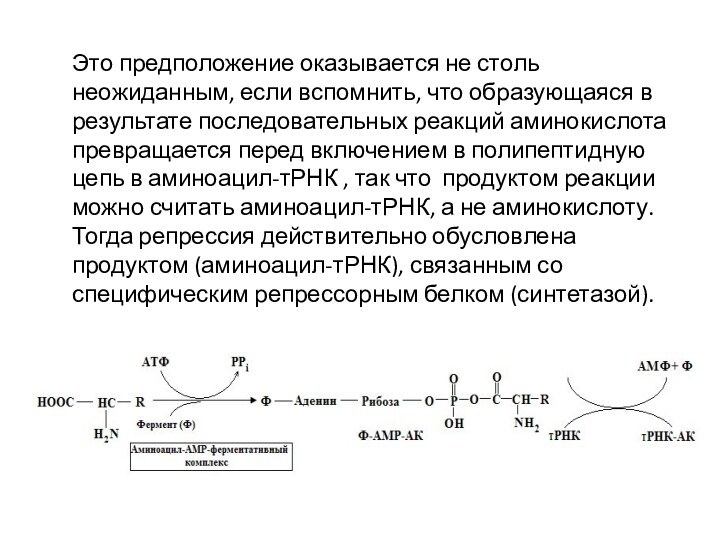
Это предположение оказывается не столь неожиданным, если вспомнить,
что образующаяся в результате последовательных реакций аминокислота превращается перед
включением в полипептидную цепь в аминоацил-тРНК , так что продуктом реакции можно считать аминоацил-тРНК, а не аминокислоту. Тогда репрессия действительно обусловлена продуктом (аминоацил-тРНК), связанным со специфическим репрессорным белком (синтетазой).
Слайд 34
Некоторые подтверждения всем этим предположениям можно получить из
анализа данных о мутациях у Salmonella, которые снимают репрессию
продуктом гистидинового оперона.
Помимо мутации в самом операторе, которые «выключают» его, такой же эффект вызывают мутации в пяти других
участках хромосомы. Одна из мутаций имеет отношение к образованию гистидил- тРНК-синтетазы, а четыре остальных- к образованию гистидиновой тРНК.
Слайд 35
Мутация his S затрагивает ген, кодирующий синтез синтетазы,
мутация his R локализована в гене, кодирующем синтез гистидиновой
тРНК, она нарушает функцию этой тРНК; his T- это мутация в гене, детерминирующем синтез фермента, который катализирует превращение U в Ψ
в антикодовой петле тРНК; his U и his W-
мутации, по-видимому связанные с модификациями оснований в тРНК. В результате трех последних мутаций образуются модифицированные тРНК; эти модификации не препятствуют связыванию тРНК с гистидином, но они нарушают правильное взаимодействие всех компонентов при функционировании механизма репрессии.
Слайд 36
Эти наблюдения прямо указывают, что и гистидил-тРНК- синтетаза,
и гистидиновая тРНК являются компонентами репрессора. С другой стороны,
попытки выделить мутанты с видоизмененным геном, кодирующим некий белок-«репрессор», оказались безуспешными, и до сих пор нет никаких доказательств существования особого белкового репрессора для гистидинового оперона, как это имеет место в случае с lac-опероном.
Имеются данные о том, что работа других оперонов, кодирующих ферменты для биосинтеза аминокислот, также регулируется соответствующими аминоацил-тРНК.
Слайд 37
Однако это правило не является универсальным: триптофановый оперон
регулируется иным путем.
Например, регуляторный белок tryp не имеет
ничего общего с триптофанил-тРНК — синтетазой и кодируется геном-регулятором tryp -оперона.
Слайд 38
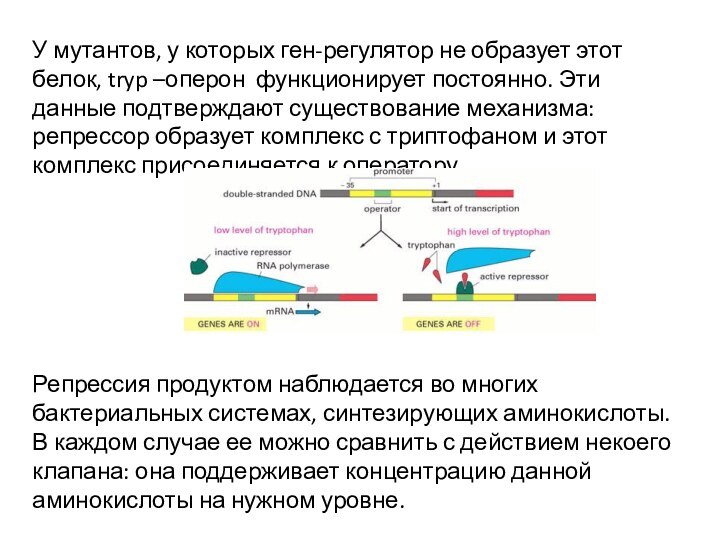
У мутантов, у которых ген-регулятор не образует этот
белок, tryp –оперон функционирует постоянно. Эти данные подтверждают существование
механизма: репрессор образует комплекс с триптофаном и этот комплекс присоединяется к оператору.
Репрессия продуктом наблюдается во многих бактериальных системах, синтезирующих аминокислоты. В каждом случае ее можно сравнить с действием некоего клапана: она поддерживает концентрацию данной аминокислоты на нужном уровне.
Слайд 39
Репрессию продуктом следует отличать от ингибирования продуктом, или
ингибирования по механизму обратной связи, которое также имеет место.
Репрессия влияет на количество фермента, а ингибирование — на его активность. Нередко продукт, образовавшийся в результате цепи реакций, катализируемых ферментами, которые кодируются данным опероном, является специфическим ингибитором первого из этих ферментов, хотя он может значительно отличаться по структуре от субстрата этого фермента. Таким образом, он блокирует работу всей цепи ферментов и осуществляет второй способ контроля, дополняющий репрессию продуктом. Репрессия не может уменьшить количество уже образовавшихся ферментов, но если появляется необходимость снизить их активность, то это может быть сделано с помощью ингибирования по механизму обратной связи.
Слайд 40
Интересно, что транспортные РНК также принимают участие (по
крайней мере в некоторых случаях) в ингибировании по механизму
обратной связи в системах, связанных с синтезом аминокислот. Известно несколько примеров, когда первый кодируемый опероном фермент специфически соединяется с той аминоацил-тРНК, аминокислота которой синтезируется ферментами данного оперона. Однако в некоторых случаях такого рода эффекты приписывали без достаточного основания не ингибированию, а репрессии.
Слайд 41
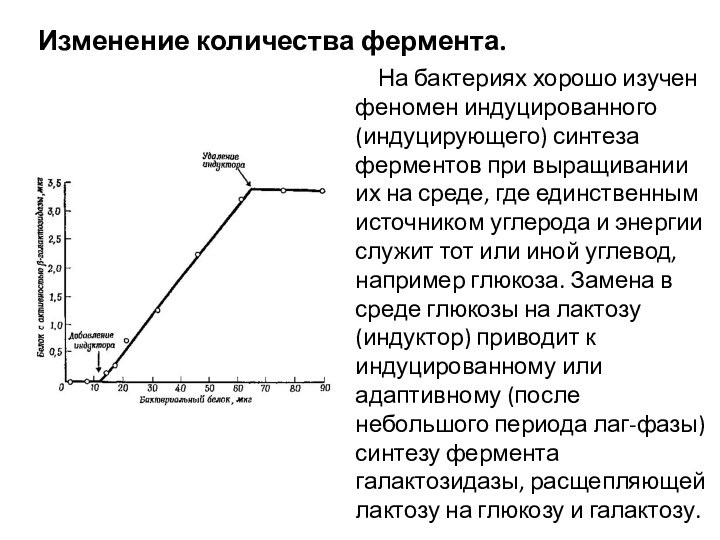
Изменение количества фермента.
На бактериях хорошо изучен феномен индуцированного (индуцирующего) синтеза
ферментов при выращивании их на среде, где единственным источником углерода и энергии служит тот или иной углевод, например глюкоза. Замена в среде глюкозы на лактозу (индуктор) приводит к индуцированному или адаптивному (после небольшого периода лаг-фазы) синтезу фермента галактозидазы, расщепляющей лактозу на глюкозу и галактозу.
Слайд 42
В клетках прокариот и эукариот имеются
ферменты, концентрация которых не требует добавления индуктора; это так
называемые конститутивные ферменты. Количество фермента в клетке зависит от наличия продукта реакции, катализируемой данным ферментом, причем продукт реакции вызывает торможение синтеза фермента в результате репрессии.
Слайд 43
В животных тканях быстрый синтез ферментов наблюдается реже.
Механизм его (индуцирующий синтез) изучен только для небольшого числа
ферментов: тирозинтрансаминазы, серин- и треониндегидратазы, триптофанпирролазы и др. – в ответ на введение гормонов или прием белковой пищи. Однако при поступлении в организм некоторых ядов, канцерогенных веществ, алкалоидов, инсектицидов через несколько дней наблюдается резкое повышение активности (соответственно количества) ферментов-гидроксилаз (монооксигеназ) эндоплазматической сети клеток печени, окисляющих чужеродные вещества в нетоксичные для организма продукты. Вполне допустимо предположить, что в этих случаях имеет место синтез ферментов путем индукции (т.е. de novo). Описаны случаи, когда под действием подобных гидроксилаз чужеродные вещества превращаются в организме в более токсичные соединения. Это явление, обратное детоксикации, получило название летального синтеза.
Слайд 44
Генетический контроль синтеза ферментов
К факторам, определяющим скорость синтеза
ферментов на рибосомах в цитоплазме, относятся как скорость транскрипции,
так и скорость деградации молекул мРНК.
Слайд 45
Некоторые ферменты называют конститутивными, подразумевая под
этим, что фермент образуется независимо от того, в каких
условиях находится клетка.
Например, бактерии
синтезируют ферменты,
необходимые для катаболизма
глюкозы, при всех условиях
роста.
Слайд 46
Ферменты другой группы, известные как индуцибельные,
часто синтезируются лишь в следовых количествах. Однако если клетки
выращивают в присутствии веществ, являющихся субстратами для этих ферментов, то последние продуцируются в гораздо больших количествах.
Так, при культивировании Е. coli
в присутствии лактозы образуется
ряд ферментов, участвующих в
катаболизме этого дисахарида.
Слайд 47
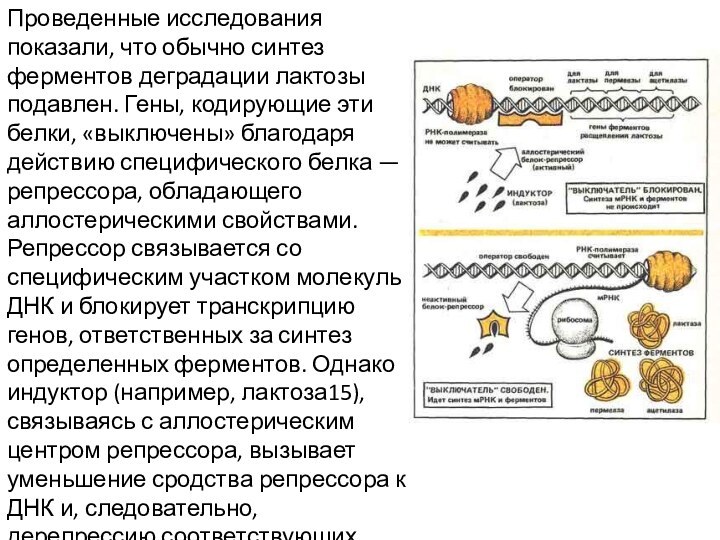
Проведенные исследования показали, что обычно синтез ферментов деградации
лактозы подавлен. Гены, кодирующие эти белки, «выключены» благодаря действию
специфического белка — репрессора, обладающего аллостерическими свойствами. Репрессор связывается со специфическим участком молекулы ДНК и блокирует транскрипцию генов, ответственных за синтез определенных ферментов. Однако индуктор (например, лактоза15), связываясь с аллостерическим центром репрессора, вызывает уменьшение сродства репрессора к ДНК и, следовательно, дерепрессию соответствующих генов.
Слайд 48
Синтез многих ферментов в клетке почти
все время подавлен. Появление специфических ферментов в тот или
иной момент времени в организме или в определенной дифференцированной ткани происходит в результате дерепрессии, вызываемой накоплением специфических метаболитов или другими, пока неизвестными факторами. В эукариотических клетках контроль за синтезом ферментов может осуществляться как на уровне транскрипции, так и на уровне трансляции.
Слайд 49
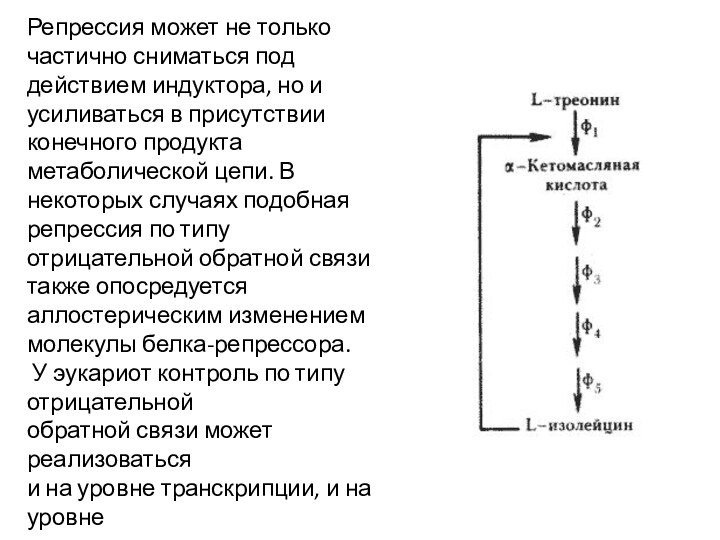
Репрессия может не только частично сниматься под действием
индуктора, но и усиливаться в присутствии конечного продукта метаболической
цепи. В некоторых случаях подобная репрессия по типу отрицательной обратной связи также опосредуется аллостерическим изменением молекулы белка-репрессора.
У эукариот контроль по типу отрицательной
обратной связи может реализоваться
и на уровне транскрипции, и на уровне
трансляции.