- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему Возникновение органической химии как науки
Содержание
- 2. Возникновение органической химиикак науки.
- 3. Студент должен:Знать:основы теории строения органических соединенийУметь:описывать свойства
- 4. Первые классификации(по происхождению):
- 5. Й. БЕРЦЕЛИУС: ВЕЩЕСТВА, ПОЛУЧАЕМЫЕ ИЗ ОРГАНИЗМОВ (РАСТИТЕЛЬНОГО
- 6. В 1824 г. НЕМЕЦКИЙ ХИМИК Ф. ВЕЛЕР
- 7. Вещества органические и не органические.Состав и некоторые свойства органических веществ.
- 8. *
- 9. Большинство органических веществ горючи, легко разлагаются (t=400-600
- 10. Органическая химия – это химия соединений углерода; химия углеводородов и их производных.
- 12. Теория типов (30 гг. XIXв. Ш. Жерар,
- 13. Б) формулы выражают не внутреннее строение молекулы,
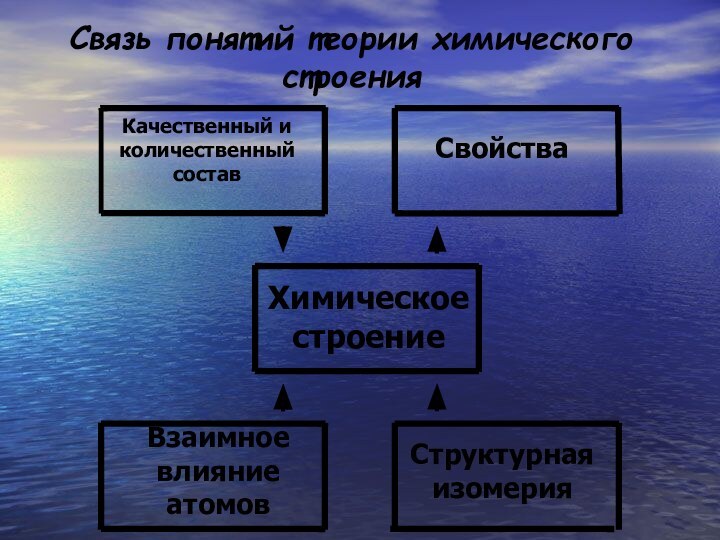
- 14. Связь понятий теории химического строенияКачественный и количественный составСвойстваХимическое строениеВзаимное влияние атомовСтруктурная изомерия
- 15. Предпосылки возникновения теории химического строения органических веществ«Органическая
- 16. Основные «противоречия» органической химии:Многообразие веществ – образовано
- 17. Предпосылки возникновения теории:1.Развитие и утверждение атомистических представлений
- 18. Теория химического строения органических соединений.Основные положения(А.М. Бутлеров 1861 – 1864 гг.)
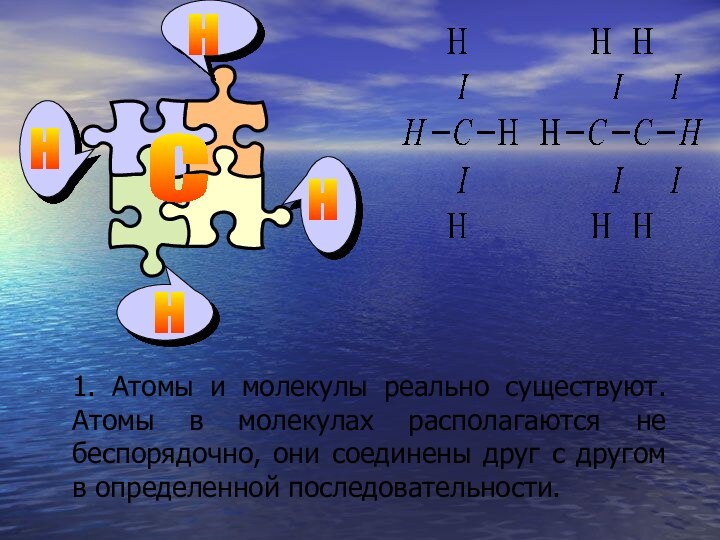
- 19. 1. Атомы и молекулы реально существуют. Атомы
- 20. 2. Атомы в молекулах соединяются в соответствии
- 21. А)Б)Структурная формула показывает порядок соединения атомов в
- 22. 3. Свойства веществ зависят не только от
- 23. 4. Различное строение при одном и том
- 25. 5. Химическое строение молекул позноваемо. Оно может
- 26. Дальнейшее развитие теории:Изучение пространственного расположения атомов –
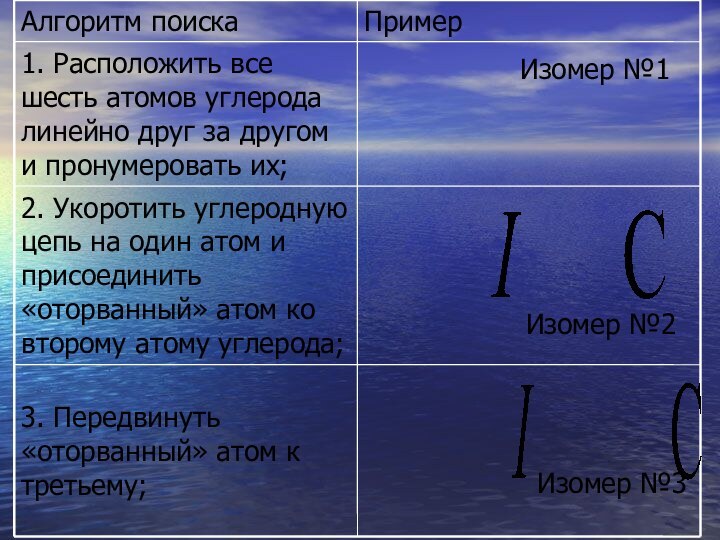
- 27. Алгоритм поиска возможных изомеров алканов (изомерия углеродного скелета).
- 28. Изомер №2Изомер №1Изомер №3
- 29. Изомер №2При нумерации цепи справа налевоИзомер №4
- 30. Изомер №5Изомер №4
- 31. Классификация химическихреакций, типичных дляорганических соединений
- 32. По типу химического превращенияреакции замещения сопровождаются образованием
- 33. реакции присоединения (синтеза) сопровождаются
- 34. реакции разложения сопровождаются образованием новых более простых по составу молекул.
- 35. метанРадикал метилРадикал водород
- 36. МЕТИЛХЛОРИДМЕТИЛ-КАТИОНХЛОРИД-АНИОН
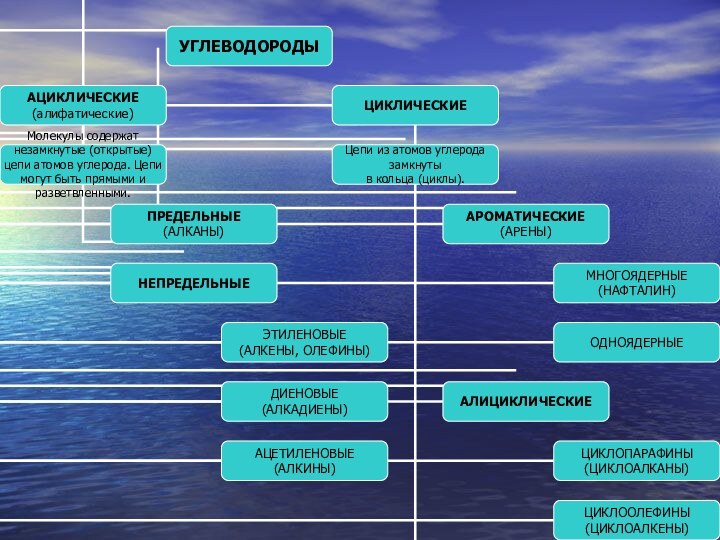
- 37. КЛАССИФИКАЦИЯУГЛЕВОДОРОДОВ
- 39. МЕТАН. ФИЗИЧЕСКИЕ СВОЙСТВА. СТРОЕНИЕ МОЛЕКУЛЫ.СН 4МЕТАНБОЛОТНЫЙ ГАЗЛегче воздухаВзрывоопасен!!!
- 40. Два «противоречия» в строении метана:Валентность углерода равна
- 41. 2. В молекуле все четыре связи одинаковые
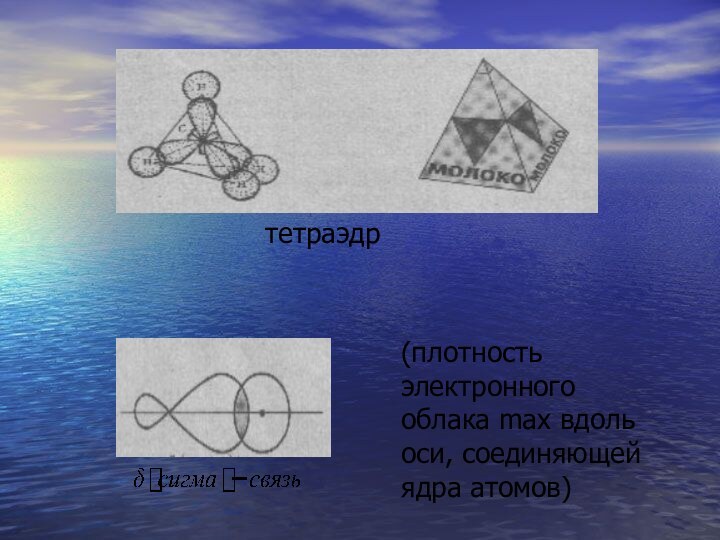
- 42. sp3Четыре орбитали
- 43. тетраэдр(плотность электронного облака max вдоль оси, соединяющей ядра атомов)
- 44. Алканы
- 45. (Предельные или насыщенные углеводороды, парафины, жирные или
- 46. Соединения, сходные по строению и химическим свойствам
- 47. ФИЗИЧЕСКИЕ СВОЙСТВА -
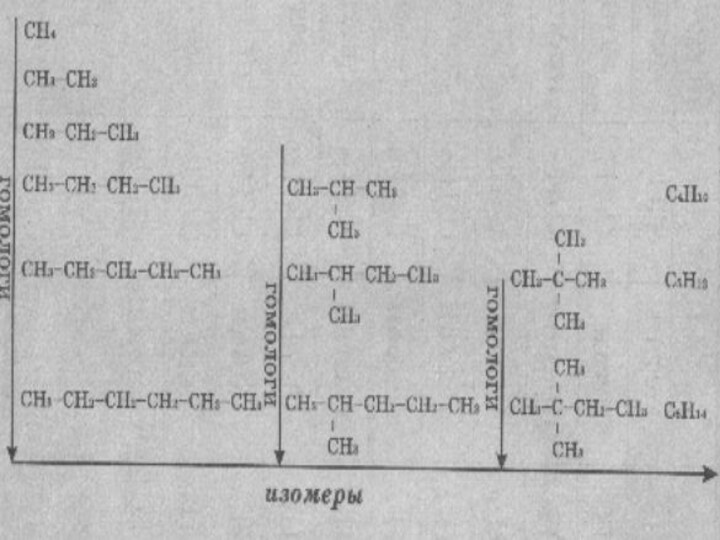
- 48. Изомеры и гомологи
- 51. Алканы (неразветвленного строения) и алкины
- 52. НоменклатураХимическая номенклатура – это система формул и
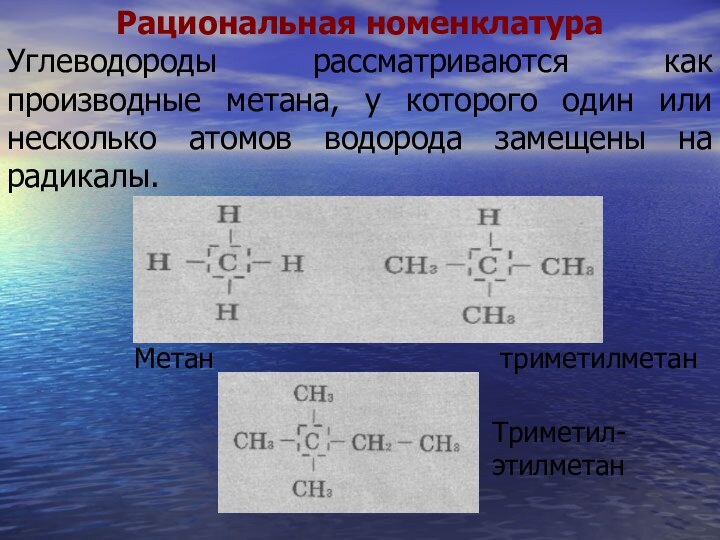
- 53. Рациональная номенклатураУглеводороды рассматриваются как производные метана, у которого один или несколько атомов водорода замещены на радикалы.МетантриметилметанТриметил-этилметан
- 54. Скачать презентацию
- 55. Похожие презентации
Возникновение органической химиикак науки.










































Слайд 3
Студент должен:
Знать:
основы теории строения органических соединений
Уметь:
описывать свойства органических
Слайд 5 Й. БЕРЦЕЛИУС: ВЕЩЕСТВА, ПОЛУЧАЕМЫЕ ИЗ ОРГАНИЗМОВ (РАСТИТЕЛЬНОГО И
ЖИВОТНОГО ПРОИСХОЖДЕНИЯ) - ОРГАНИЧЕСКИЕ, НАУКА, ИХ ИЗУЧАЮЩАЯ - ОРГАНИЧЕСКАЯ
ХИМИЯ.ОШИБКА БЕРЦЕЛИУСА: ОРГАНИЧЕСКИЕ ВЕЩЕСТВА НЕЛЬЗЯ ПОЛУЧАТЬ В ЛАБОРАТОРИИ, КАК НЕОРГАНИЧЕСКИЕ. ОНИ СОЗДАЮТСЯ ОРГАНИЗМАМИ ПОД ВЛИЯНИЕМ «ЖИЗНЕНОЙ СИЛЫ»
ВИТАЛИСТИЧЕСКОЕ УЧЕНИЕ О «ЖИЗНЕННОЙ СИЛЕ» ОШИБОЧНО (от лат. VITA – ЖИЗНЬ)
Слайд 6 В 1824 г. НЕМЕЦКИЙ ХИМИК Ф. ВЕЛЕР (УЧЕНИК
БЕРЦЕЛИУСА) СИНТЕЗИРОВАЛ ИЗ НЕОГАНИЧЕСКИХ ВЕЩЕСТВ ЩАВЕЛЕВУЮ КИСЛОТУ.
1828 г.- МОЧЕВИНУ
(Ф. ВЕЛЕР)1845 г.- УКСУСНУЮ КИСЛОТУ
(А. КОЛЬБЕ)
1854 г.- ЖИРЫ (М. БЕРТЛО)
1861 г.- САХАРИСТЫЕ ВЕЩЕСТВА
(А. БУТЛЕРОВ)
Слайд 9 Большинство органических веществ горючи, легко разлагаются (t=400-600 С),
легко взаимопревращаются.
Углерод в органических веществах обнаруживают по образованию оксида
углерода (IV) - , по выделению копоти при горении, по обугливанию.Слайд 11
ДОСТРУКТИВНЫЕ ТЕОРИИ
Теория радикалов (30 гг. XIXв. Й. Берцелиус, Ю.
Либих, Ж. Дюма)А) в состав органических веществ входят радикалы;
Б) радикалы всегда постоянны, не подвергаются изменениям, переходят из одной молекулы в другую;
В) радикалы могут существовать в свободном виде.
Понятие «радикал» прочно вошло в химию. Теория впоследствии отвергнута.
Слайд 12 Теория типов (30 гг. XIXв. Ш. Жерар, А.
Кекуле и др.)
А) все органические вещества – производные простейших
неорганических – типа водорода, воды, аммиака и др.тип водорода тип воды
Б) формулы выражают не внутреннее строение молекулы, а способы образования, свойства определяют все атомы молекулы.
Метан
Этан
Спирт
Простой эфир
Слайд 13 Б) формулы выражают не внутреннее строение молекулы, а
способы образования, свойства определяют все атомы молекулы.
В) невозможно познать
строение вещества, у каждого вещества столько формул, сколько его превращений существует.Теория позволила классифицировать органические вещества, предсказать и открыть некоторые, особое внимание – химическим превращениям, но не могла прогнозировать, указывать пути синтеза новых веществ.
Слайд 14
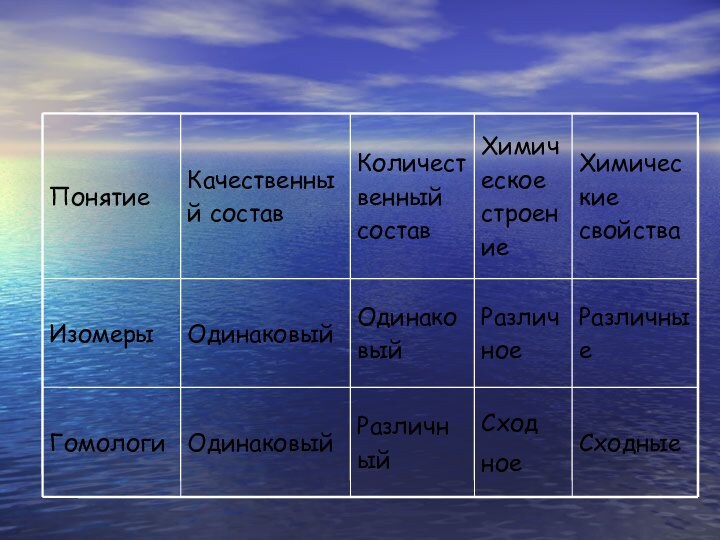
Связь понятий теории химического строения
Качественный и количественный состав
Свойства
Химическое
строение
Взаимное влияние атомов
Структурная изомерия
Слайд 15
Предпосылки возникновения теории химического строения органических веществ
«Органическая химия
может сейчас кого угодно свести с ума. Она представляется
мне дремучим лесом, полным удивительных вещей, безграничной чащей, из которой нельзя выбраться, куда не осмеливаешься проникнуть»(Из письма Ф.Велера к Й.Берцелиусу 1835г.)
Слайд 16
Основные «противоречия» органической химии:
Многообразие веществ – образовано небольшим
числом элементов;
Кажущееся несоответствие валентности в органических веществах -
;Различные физические и химические свойства соединений, имеющих одинаковую молекулярную формулу. - глюкоза, фруктоза; - бутиловый спирт, диэтиловый эфир.
Слайд 17
Предпосылки возникновения теории:
1.Развитие и утверждение атомистических представлений (съезд
в Карлсруэ, 1860);
2.Установление понятия валентности
(Э. Франкланд, 1853);3.Понятие четырех валентности углерода (А.Кекуле, 1858);
4.Идеи о соединении атомов углерода в цепи (А.Кекуле, А.Купер, 1857).
Целостной теории, подтвержденной экспериментом, не существовало.
Слайд 18
Теория химического строения органических соединений.
Основные положения
(А.М. Бутлеров 1861
– 1864 гг.)
Слайд 19 1. Атомы и молекулы реально существуют. Атомы в
молекулах располагаются не беспорядочно, они соединены друг с другом
в определенной последовательности.Н
Н
Н
Н
С
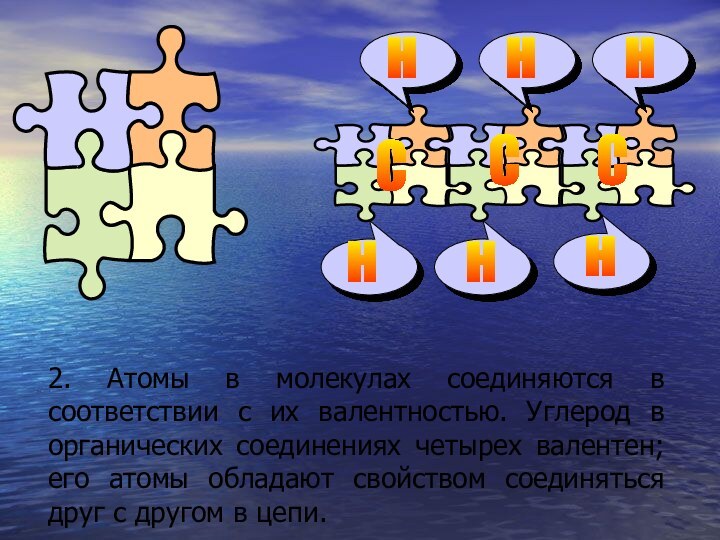
Слайд 20 2. Атомы в молекулах соединяются в соответствии с
их валентностью. Углерод в органических соединениях четырех валентен; его
атомы обладают свойством соединяться друг с другом в цепи.С
С
С
Н
Н
Н
Н
Н
Н
Слайд 21
А)
Б)
Структурная формула показывает порядок соединения атомов в молекуле,
их взаимосвязь друг с другом.
(а – развернутая; б –
сокращенная)Слайд 22 3. Свойства веществ зависят не только от того,
атомы каких элементов и в каком количестве входят в
состав молекул, но и от последовательности соединения атомов в молекулах, от взаимного влияния их друг на друга.Слайд 23 4. Различное строение при одном и том же
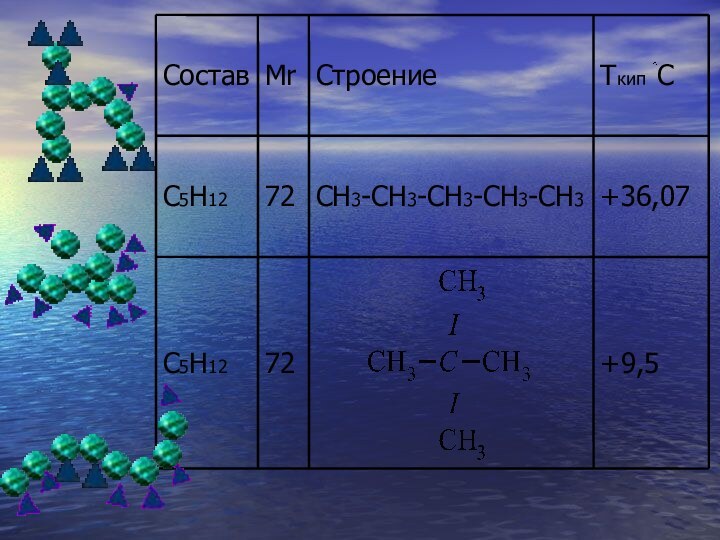
составе и относительной молекулярной массе вещества обуславливает явление изомерии.
Изомеры – вещества, имеющие одинаковый состав молекул (одну и ту же молекулярную формулу), но различное химическое строение и обладающие по этому различными свойствами.
Слайд 25 5. Химическое строение молекул позноваемо. Оно может быть
установлено путем синтеза из веществ известного состава и продуктов
его превращений.
Слайд 26
Дальнейшее развитие теории:
Изучение пространственного расположения атомов – стерео
химия;
Изучение органических веществ с применением электронного учения строения атома.
«Вряд
ли можно называть другую отрасль науки, в которой единственная теория занимала бы такое доминирующее и определяющее курс положение, как теория строения А.М.Бутлерова в органической химии. Более ста дет она служит стержнем развития и расцвета этой науки»(акад. А.Н.Несмеянов)
Слайд 32
По типу химического превращения
реакции замещения сопровождаются образованием новых
ковалентных связей при замещении
одного атома (или
группы атомом) на другие атомы или группы.Слайд 33 реакции присоединения (синтеза) сопровождаются образованием
новых б (сигма) - связей за
счет разрыва (пи)
- связей.
Слайд 39
МЕТАН. ФИЗИЧЕСКИЕ СВОЙСТВА. СТРОЕНИЕ МОЛЕКУЛЫ.
СН
4
МЕТАН
БОЛОТНЫЙ ГАЗ
Легче воздуха
Взрывоопасен!!!
Слайд 40
Два «противоречия» в строении метана:
Валентность углерода равна четырем
– в наличии только 2 валентных электрона
Выход – возбужденное
состояние углеродаn=2
S
P
n=2
P
S
Слайд 41 2. В молекуле все четыре связи одинаковые –
по теории – одна ss связь и три sp
связи.Выход –
Гибридизация – изменение формы и энергии различных орбиталей одного атома, приводящее к образованию одинаковых (гибридных) орбиталей.
Слайд 45 (Предельные или насыщенные углеводороды, парафины, жирные или алифатические
соединения)
Соединения углерода с водородом, в молекулах которых атомы углерода
соединены между собой одинарной ( - сигма) связью, а все остальные валентности насыщены атомами водорода.Слайд 46 Соединения, сходные по строению и химическим свойствам и
отличающиеся друг от друга на одну или несколько групп
, называют гомологами.ГРУППА - ГОМОЛОГИЧЕСКАЯ РАЗНОСТЬ.
Слайд 47
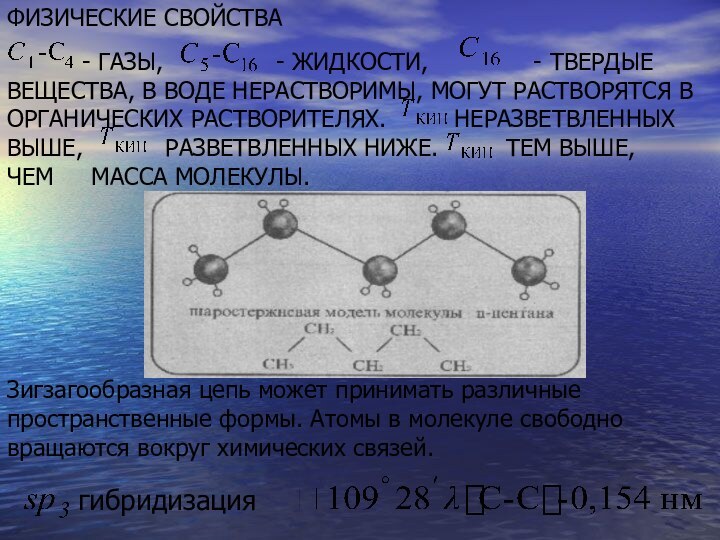
ФИЗИЧЕСКИЕ СВОЙСТВА
- ГАЗЫ,
- ЖИДКОСТИ,
- ТВЕРДЫЕ ВЕЩЕСТВА, В ВОДЕ НЕРАСТВОРИМЫ, МОГУТ РАСТВОРЯТСЯ В ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЯХ. НЕРАЗВЕТВЛЕННЫХ ВЫШЕ, РАЗВЕТВЛЕННЫХ НИЖЕ. ТЕМ ВЫШЕ, ЧЕМ МАССА МОЛЕКУЛЫ.Зигзагообразная цепь может принимать различные пространственные формы. Атомы в молекуле свободно вращаются вокруг химических связей.
гибридизация