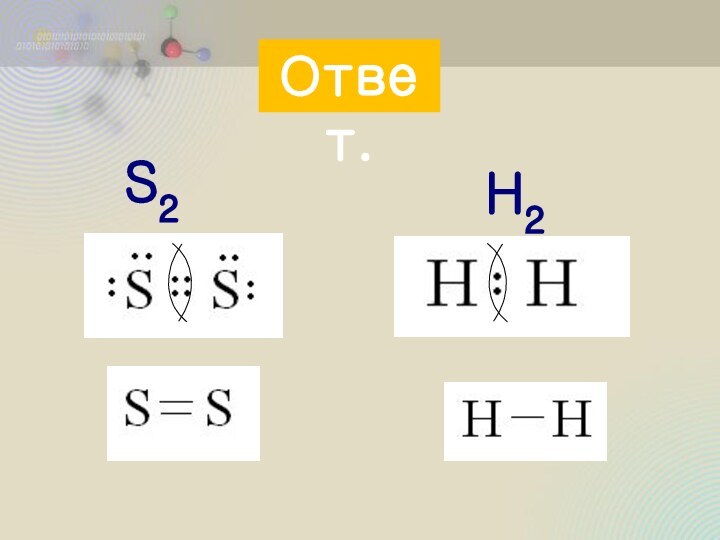
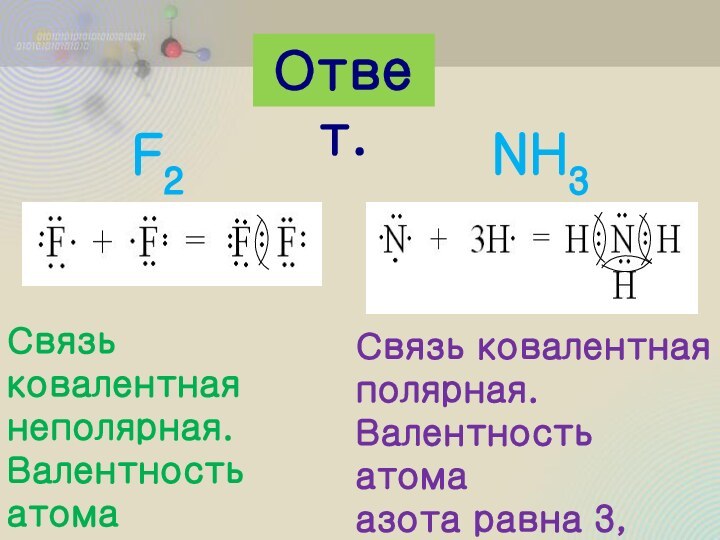
пара
принадлежит обоим
атомам в равной
степени
Молекула состоит из
атомов разных
элементов, и общая
электронная пара
смещена в сторону
атома с более
выраженными
неметаллическими
свойствами