- Главная
- Разное
- Бизнес и предпринимательство
- Образование
- Развлечения
- Государство
- Спорт
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Религиоведение
- Черчение
- Физкультура
- ИЗО
- Психология
- Социология
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Геометрия
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Что такое findslide.org?
FindSlide.org - это сайт презентаций, докладов, шаблонов в формате PowerPoint.
Обратная связь
Email: Нажмите что бы посмотреть
Презентация на тему КРИСТАЛЛИЧЕСКАЯ СЕРА
Содержание
- 2. СЕРААллотропные модификации серыПрименение серыСера в природеФизические свойстваХимические свойстваПолучение серы
- 3. Чтобы изучить свойства вещества необходимо знать его электронное строение Лайнус Полинг
- 4. ПЛАН ХАРАКТЕРИСТИКИ1. Название, химический символ и относительная
- 5. СЕРААллотропные модификации серыAr (S)=32Сера в природеПрименение
- 6. Французский химик. Один из основоположников классической химии.Ввел
- 7. СЕРА В ПРИРОДЕ«Нет ни единой руды, нет
- 8. ПРИРОДНЫЕ МЕСТОРОЖДЕНИЯ СЕРЫ
- 9. МЕСТОРОЖДЕНИЯ СЕРЫ В САМАРСКОЙ ОБЛАСТИ
- 10. СЕРААллотропные модификации серыAr (S)=32Применение серы:Степени окисленияСера
- 11. ПОЛУЧЕНИЕ СЕРЫМетод Фраша. Выплавление серы под землёй
- 12. СЕРААллотропные модификации серыAr (S)=32Применение серы:Степени окисленияСера
- 13. КРИСТАЛЛИЧЕСКАЯ СЕРА
- 14. СЕРАСветло-желтое хрупкое твердое вещество, имеет специфический
- 15. РОМБИЧЕСКАЯ СЕРААЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫМОНОКЛИННАЯ СЕРАИгольчатые кристаллы,
- 17. РОМБИЧЕСКАЯ СЕРААЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫМОНОКЛИННАЯ СЕРАПЛАСТИЧЕСКАЯ СЕРАИгольчатые кристаллы,
- 18. СЕРАСветло-желтое хрупкое твердое вещество, в чистом
- 19. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИHg + S
- 20. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ Н2+S =
- 21. СЕРАСветло-желтое хрупкое твердое вещество, в чистом
- 22. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ Н2+S =
- 23. СЕРАСветло-желтое хрупкое твердое вещество, в чистом
- 24. ПРИМЕНЕНИЕ СЕРЫ«Сера - двигатель химической промышленности» А.Е.ФерсманДля
- 25. БИОЛОГИЧЕСКАЯ РОЛЬ СЕРЫЖизненно важный элемент для высших
- 26. СЕРАСветло-желтое хрупкое твердое вещество, в чистом
- 27. Интернет:http://ru.wikipedia.org; http://links.alhimik.ru/teleclasshttp://mediateka.km.ru/bes_2002http://him.1september.ru;
- 28. Скачать презентацию
- 29. Похожие презентации















Слайд 2
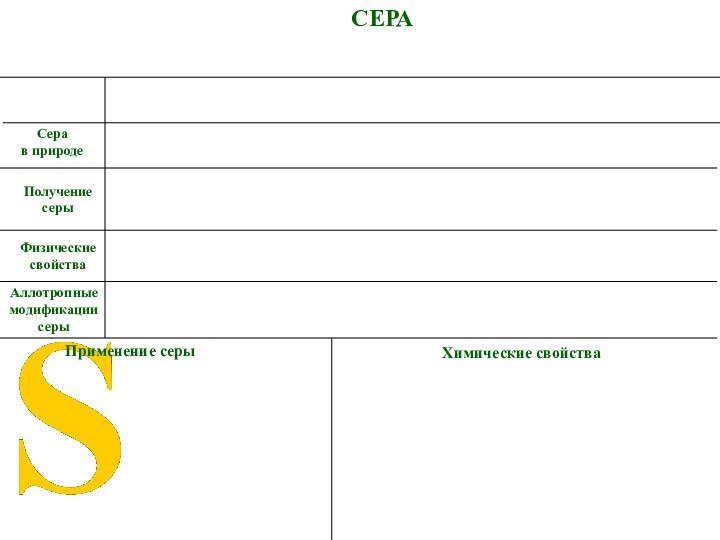
СЕРА
Аллотропные модификации серы
Применение серы
Сера
в природе
Физические свойства
Химические свойства
Получение
серы
Слайд 4
ПЛАН ХАРАКТЕРИСТИКИ
1. Название, химический символ и относительная атомная
масса элемента.
2. Атомный (порядковый) номер.
3. Положение элемента в периодической
системе химических элементов.Строение атомов химического элемента
4. Заряд ядра атома элемента.
5. Число протонов.
6. Число нейтронов.
7. Общее количество электронов.
8. Схема строения электронной оболочки атомов.
9. Электронно – графическая формула.
10. К какому классу относится элемент по свойствам атома.
Возможные степени окисления для атомов данного элемента
11. Высшая степень окисления.
12. Минимальная степень окисления.
13. Промежуточные степени окисления.
14. В какой роли (окислителя или восстановителя) элемент может
выступать в окислительно-восстановительных реакциях.
Слайд 5
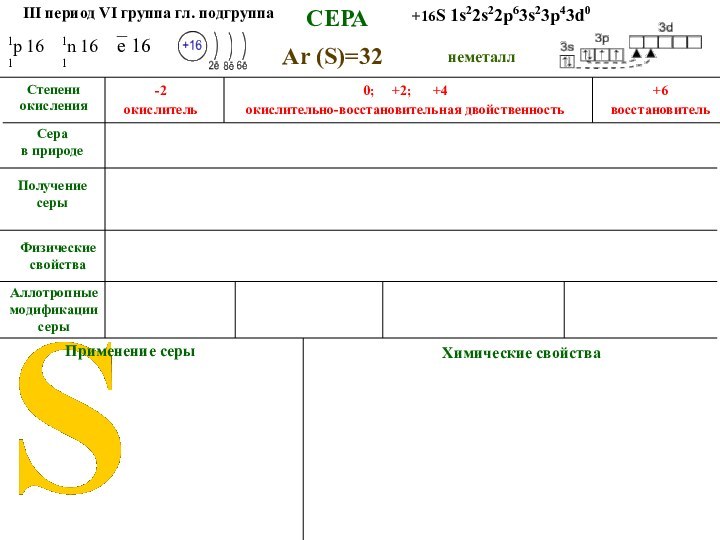
СЕРА
Аллотропные модификации серы
Ar (S)=32
Сера
в природе
Применение серы
Химические свойства
неметалл
III
период VI группа гл. подгруппа
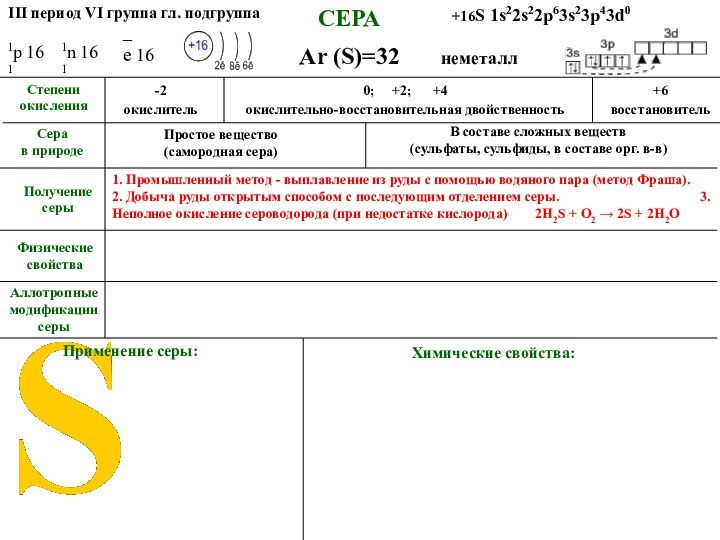
+16S 1s22s22p63s23p43d0
1р 16
1
1n 16
1
Физические свойства
Получение
серы_ е 16
Слайд 6
Французский химик. Один из основоположников классической химии.
Ввел в
химию строгие количественные методы исследования.
Доказал сложный состав атмосферного
воздуха. Первым убедился в том, что сера – самостоятельный химический элемент, а не соединение.
ИСТОРИЯ ОТКРЫТИЯ
Слайд 7
СЕРА В ПРИРОДЕ
«Нет ни единой руды, нет почти
ни единого камня, который бы через взаимное с другими
трение не дал от себя серного духу и не объявил тем самым её в себе присутствие»М.В.Ломоносов
СЕРА В ПРИРОДЕ
ПРОСТОЕ ВЕЩЕСТВО
САМОРОДНАЯ СЕРА
15-тый по распространённости химический элемент на Земле
(седьмой среди неметаллов).
Шестой элемент по содержанию в природных водах.
Содержание серы в земной коре составляет 0,05% по весу.
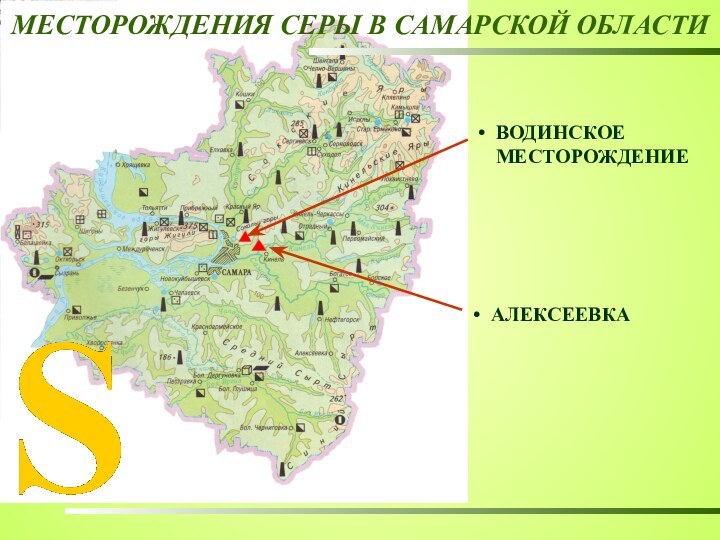
Слайд 10
СЕРА
Аллотропные модификации серы
Ar (S)=32
Применение серы:
Степени
окисления
Сера
в природе
Получение серы
Простое
вещество
(самородная сера)
В составе сложных веществ
(сульфаты, сульфиды, в составе
орг. в-в)Химические свойства:
III период VI группа гл. подгруппа
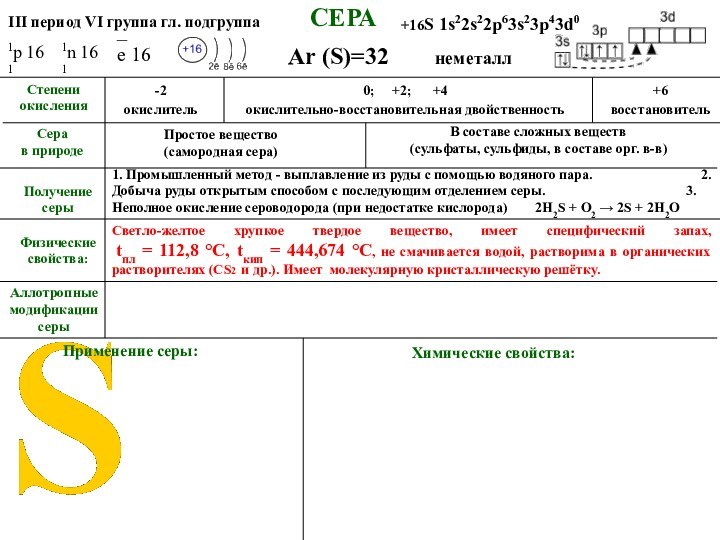
+16S 1s22s22p63s23p43d0
1р 16
1
1n 16
1
Физические свойства
неметалл
_ е 16
Слайд 11
ПОЛУЧЕНИЕ СЕРЫ
Метод Фраша. Выплавление серы под землёй с
помощью водяного пара и выкачивание на поверхность из скважин.
(Герман Фраш 1890г.)Добыча руды открытым способом. Полученную руду расплавляют в автоклавах, расплавленную серу сливают, а примеси остаются на дне.
3. Серу можно получить из соединений : Неполное окисление сероводорода (при недостатке кислорода).
2H2S + O2 →2S + 2H2O
Слайд 12
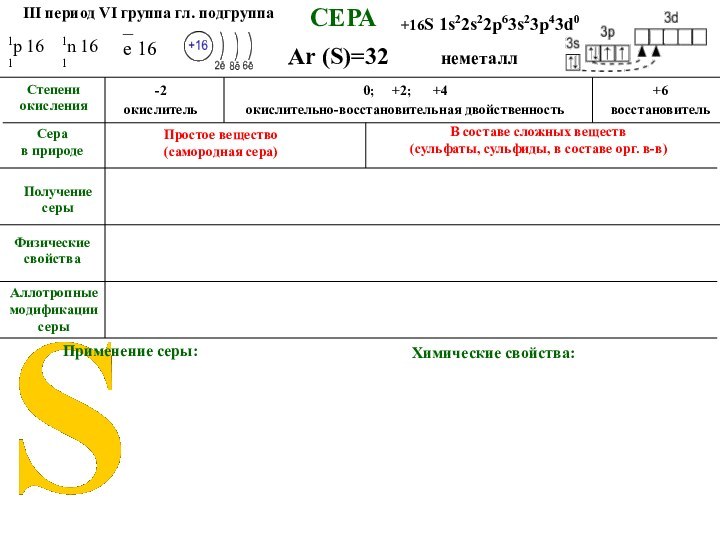
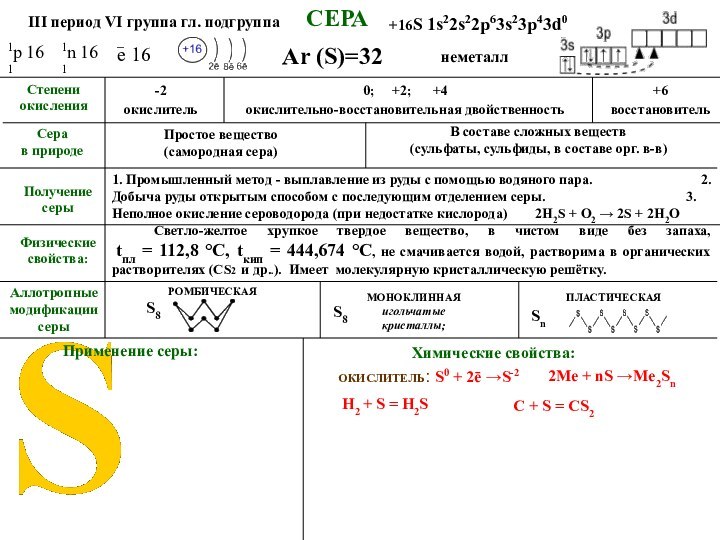
СЕРА
Аллотропные модификации серы
Ar (S)=32
Применение серы:
Степени
окисления
Сера
в природе
Простое вещество
(самородная
сера)
В составе сложных веществ
(сульфаты, сульфиды, в составе орг.
в-в)Химические свойства:
III период VI группа гл. подгруппа
+16S 1s22s22p63s23p43d0
1р 16
1
1n 16
1
1. Промышленный метод - выплавление из руды с помощью водяного пара (метод Фраша). 2. Добыча руды открытым способом с последующим отделением серы. 3. Неполное окисление сероводорода (при недостатке кислорода) 2H2S + O2 → 2S + 2H2O
Получение серы
Физические свойства
_ е 16
неметалл
Слайд 14
СЕРА
Светло-желтое хрупкое твердое вещество, имеет специфический запах,
tпл = 112,8 °C, tкип = 444,674 °C,
не смачивается водой, растворима в органических растворителях (СS2 и др.). Имеет молекулярную кристаллическую решётку.Аллотропные модификации серы
Ar (S)=32
Применение серы:
Степени
окисления
Сера
в природе
Физические свойства:
Простое вещество
(самородная сера)
В составе сложных веществ
(сульфаты, сульфиды, в составе орг. в-в)
Химические свойства:
Получение
серы
III период VI группа гл. подгруппа
+16S 1s22s22p63s23p43d0
1р 16
1
1n 16
1
неметалл
1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Добыча руды открытым способом с последующим отделением серы. 3. Неполное окисление сероводорода (при недостатке кислорода) 2H2S + O2 → 2S + 2H2O
_ е 16
Слайд 15
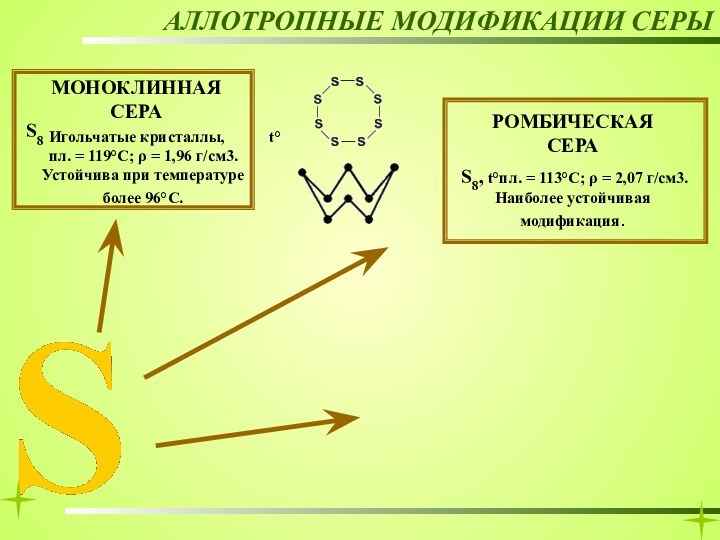
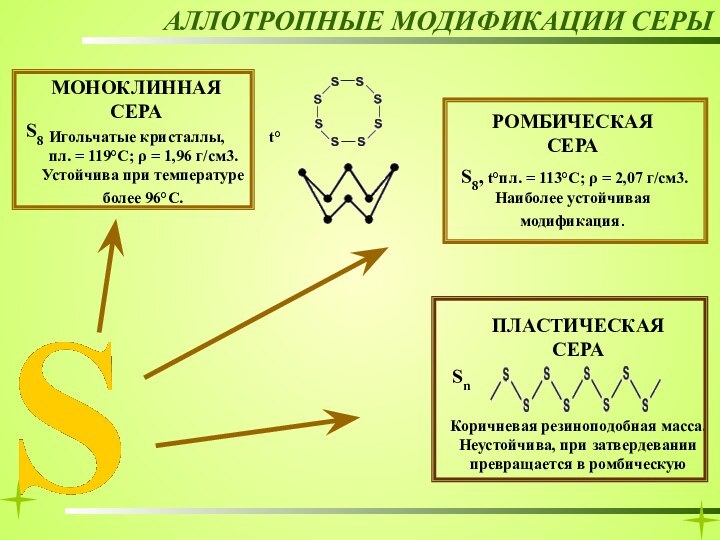
РОМБИЧЕСКАЯ СЕРА
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ
МОНОКЛИННАЯ СЕРА
Игольчатые кристаллы,
t°пл. = 119°C; ρ = 1,96
г/см3. Устойчива при температуре более 96°С. S8, t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
S8
Слайд 17
РОМБИЧЕСКАЯ СЕРА
АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ
МОНОКЛИННАЯ СЕРА
ПЛАСТИЧЕСКАЯ СЕРА
Игольчатые кристаллы,
t°пл. = 119°C; ρ =
1,96 г/см3. Устойчива при температуре более 96°С. S8, t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация.
Sn
Коричневая резиноподобная масса. Неустойчива, при затвердевании превращается в ромбическую
S8
Слайд 18
СЕРА
Светло-желтое хрупкое твердое вещество, в чистом виде
без запаха, tпл = 112,8 °C, tкип =
444,674 °C, не смачивается водой (флотация), растворима в органических растворителях (СS2 и др..). Имеет молекулярную кристаллическую решётку.Аллотропные модификации серы
МОНОКЛИННАЯ
игольчатые кристаллы; S8
ПЛАСТИЧЕСКАЯ
Ar (S)=32
Применение серы:
Степени
окисления
Сера
в природе
Физические свойства:
Простое вещество
(самородная сера)
В составе сложных веществ
(сульфаты, сульфиды, в составе орг. в-в)
Химические свойства:
Получение
серы
III период VI группа гл. подгруппа
+16S 1s22s22p63s23p43d0
1р 16
1
1n 16
1
Sn
неметалл
1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Добыча руды открытым способом с последующим отделением серы. 3. Неполное окисление сероводорода (при недостатке кислорода) 2H2S + O2 → 2S + 2H2O
_ е 16
Слайд 19
ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ
ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
Hg + S =
HgS
(при н.у. медленно)2Al + 3S = Al2S3 (150-200º C)
2Na + S = Na2S (выше 130º C)
Сa + S = CaS (150º C)
Fe + S = FeS (600-950º C)
0
0
+2
-2
2е
Слайд 20
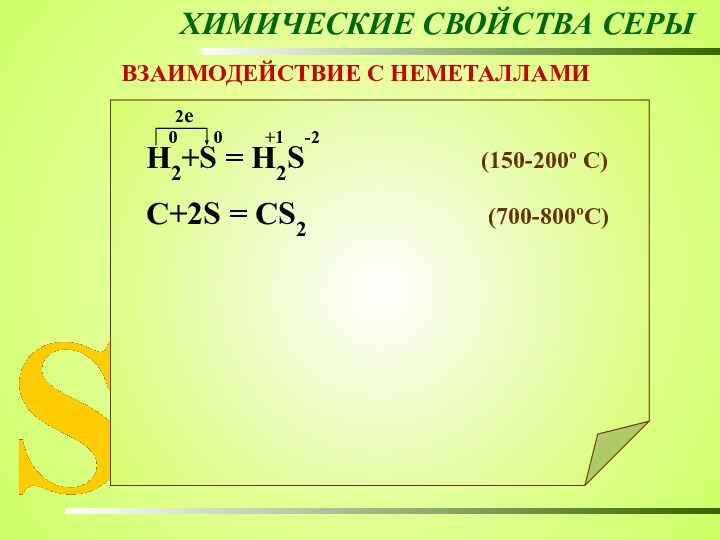
ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ
ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ
Н2+S = Н2S
(150-200º C)
C+2S = CS2 (700-800ºC)
0
0
+1
-2
2е
Слайд 21
СЕРА
Светло-желтое хрупкое твердое вещество, в чистом виде
без запаха, tпл = 112,8 °C, tкип =
444,674 °C, не смачивается водой, растворима в органических растворителях (СS2 и др..). Имеет молекулярную кристаллическую решётку.Аллотропные модификации серы
МОНОКЛИННАЯ
игольчатые кристаллы;
ПЛАСТИЧЕСКАЯ
Ar (S)=32
Применение серы:
Степени
окисления
Сера
в природе
Физические свойства:
Простое вещество
(самородная сера)
В составе сложных веществ
(сульфаты, сульфиды, в составе орг. в-в)
Химические свойства:
РОМБИЧЕСКАЯ
S8
Получение
серы
ОКИСЛИТЕЛЬ: S0 + 2ē →S-2
2Мe + nS →Me2Sn
H2 + S = H2S
C + S = CS2
III период VI группа гл. подгруппа
+16S 1s22s22p63s23p43d0
1р 16
1
1n 16
1
неметалл
S8
Sn
1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Добыча руды открытым способом с последующим отделением серы. 3. Неполное окисление сероводорода (при недостатке кислорода) 2H2S + O2 → 2S + 2H2O
_ е 16
Слайд 22
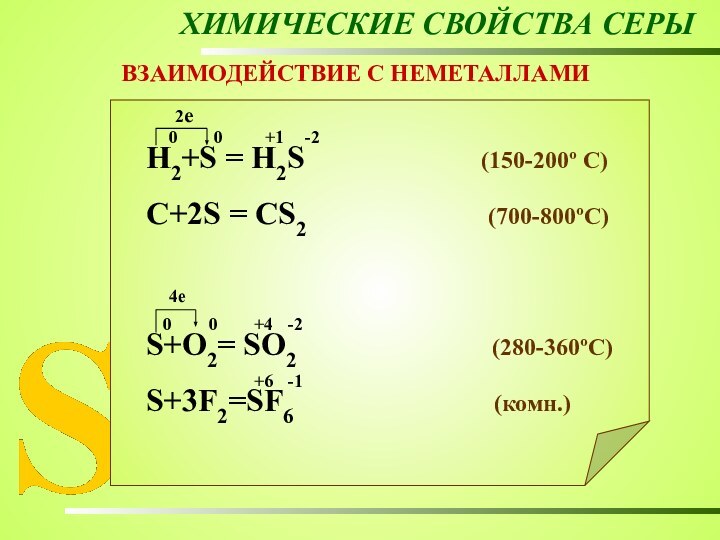
ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ
ВЗАИМОДЕЙСТВИЕ С НЕМЕТАЛЛАМИ
Н2+S = Н2S
(150-200º C)
C+2S = CS2 (700-800ºC)
S+O2= SO2 (280-360ºC)
S+3F2=SF6 (комн.)
0
0
+1
-2
2е
0
0
-2
+4
4е
-1
+6
Слайд 23
СЕРА
Светло-желтое хрупкое твердое вещество, в чистом виде
без запаха, tпл = 112,8 °C, tкип =
444,674 °C, не смачивается водой, растворима в органических растворителях (СS2 и др..). Имеет молекулярную кристаллическую решётку.Аллотропные модификации серы
МОНОКЛИННАЯ
игольчатые кристаллы;
ПЛАСТИЧЕСКАЯ
Ar (S)=32
Применение серы:
Степени
окисления
Сера
в природе
Физические свойства:
Простое вещество
(самородная сера)
В составе сложных веществ
(сульфаты, сульфиды, в составе орг. в-в)
Химические свойства:
РОМБИЧЕСКАЯ
S8
Получение
серы
S + O2 = SO2 S + F2 = SF6
S + 6HNO3 (конц.) = H2SO4 + 6NO2↑ + 2H2O
ВОССТАНОВИТЕЛЬ: S0 - 4ē → S+4; S0 - 6ē →S+6
ОКИСЛИТЕЛЬ: S0 + 2ē →S-2
2Мe + nS →Me2Sn
H2 + S = H2S
C + S = CS2
III период VI группа гл. подгруппа
+16S 1s22s22p63s23p43d0
1р 16
1
1n 16
1
неметалл
S8
Sn
1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Добыча руды открытым способом с последующим отделением серы. 3. Неполное окисление сероводорода (при недостатке кислорода) 2H2S + O2 → 2S + 2H2O
_ е 16
Слайд 24
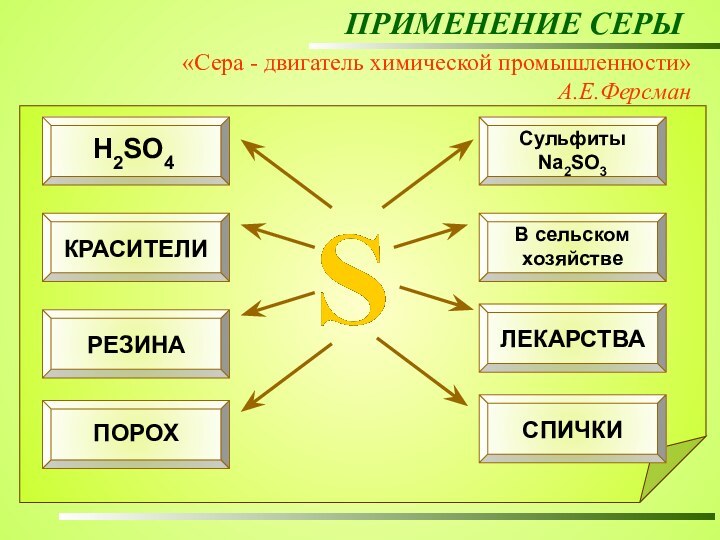
ПРИМЕНЕНИЕ СЕРЫ
«Сера - двигатель химической промышленности»
А.Е.Ферсман
Для того
чтобы изготовить автомобиль, нужно израсходовать около 14 кг серы.
В
бумажной промышленности соединения серы помогают выделить целлюлозу. Для того чтобы произвести 1 т целлюлозы, нужно затратить более 100 кг серы. 25% добываемой в мире серы идет на получение сульфитов, используемых в производстве бумаги. Основной потребитель серы – химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты. Чтобы получить 1 т H2SО4 нужно сжечь около 300 кг серы.
В производстве 88 из 150 важнейших химических продуктов используют либо саму серу, либо ее соединения.
Слайд 25
БИОЛОГИЧЕСКАЯ РОЛЬ СЕРЫ
Жизненно важный элемент для высших организмов,
составная часть многих белков, концентрируется в волосах.
Также много серы
в биологически активных веществах (например, в витаминах). Играет значительную роль в процессах обезвреживания ядовитых веществ в печени.
Основные источники серы - продукты животного происхождения, но довольно значительно ее содержание и в растительной пище. Сыр содержит 263 мг серы в 100 г продукта, яйца, мясо - 230, рыба - 175, горох, фасоль, овсяная крупа - более 200, другие крупы и хлеб - более 100 мг.
Потребность организма в сере около 1 г в сутки.
Слайд 26
СЕРА
Светло-желтое хрупкое твердое вещество, в чистом виде
без запаха, tпл = 112,8 °C, tкип =
444,674 °C, не смачивается водой, растворима в органических растворителях (СS2 и др..). Имеет молекулярную кристаллическую решётку.Аллотропные модификации серы
МОНОКЛИННАЯ
игольчатые кристаллы
ПЛАСТИЧЕСКАЯ
Ar (S)=32
Применение серы
производство серной кислоты;
производство бумаги;
вулканизация резины;
получение красителей;
в сельском хохяйстве – удобрения и ядохимикаты;
производство лекарственных препаратов;
производство пороха и спичек и др.
Степени
окисления
Сера
в природе
Физические свойства
Простое вещество
(самородная сера)
В составе сложных веществ
(сульфаты, сульфиды, в составе орг. в-в)
Химические свойства
РОМБИЧЕСКАЯ
Получение
серы
S + O2 = SO2 S + F2 = SF6
S + 6HNO3 (конц.) = H2SO4 + 6NO2↑ + 2H2O
3S0 + 6KOH(конц.) = 2K2S-2 + K2S+4O3 + 3H2O
ВОССТАНОВИТЕЛЬ: S0 - 4ē → S+4; S0 - 6ē →S+6
ДИСПРОПОРЦИОНИРОВАНИЕ
ОКИСЛИТЕЛЬ: S0 + 2ē →S-2
2Мe + nS →Me2Sn
H2 + S = H2S
C + S = CS2
III период VI группа гл. подгруппа
+16S 1s22s22p63s23p43d0
1р 16
1
1n 16
1
неметалл
S8
Sn
S8
1. Промышленный метод - выплавление из руды с помощью водяного пара. 2. Добыча руды открытым способом с последующим отделением серы. 3. Неполное окисление сероводорода (при недостатке кислорода) 2H2S + O2 → 2S + 2H2O
_ е 16
Слайд 27
Интернет:
http://ru.wikipedia.org;
http://links.alhimik.ru/teleclass
http://mediateka.km.ru/bes_2002
http://him.1september.ru;
http://bizinfo.otrok.ru
http://www.alhimik.ru/teleclass/konspect
http://www.rossibneft.ru/showpage/sprav/chem
CD:
«Виртуальная лаборатория 9 класс»; «Базовый курс химии 8-9класс»; «Общая и неорганическая химия» Образовательная коллекция 1С; «Уроки химии Кирилла и Мефодия» Виртуальная школа Кирилла и Мефодия; «1С: Репетитор. Химия».
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ ПО ТЕМЕ:





























