Химия - наука, изучающая строение веществ и их превращения,
сопровождающиеся изменением состава и (или) строения."Химическая энциклопедия" (под редакцией Зефирова Н.С. М.:Большая российская энциклопедия, 1998, т. 5, стр. 506)
Химия лучшая в мире наука, жизнь без неё это скука!!!







![Лиганд [Co(NH3)6]3+ - комплекс [Co(NH3)6]Cl3 – комплексное соединение (соль).[Fe(CO)5] – комплекс и комплексное](/img/tmb/12/1131179/ec72016fa808414c3c6200136da09847-720x.jpg)
![Лиганд Строение комплексного соединенияK3 [Fe(CN)6]Ион-комплексообразователь(центральный атом)ЛигандыКоординационное числоВнутренняя сфераВнешняя сфера](/img/tmb/12/1131179/91432ec126a9029d93ac0713e5d21ab6-720x.jpg)


![Лиганд Примеры лигандовАнионы бескислородных кислотF-, Cl-, Br-, I- (фторо-лиганд и т.д.)Пример: K2[HgI4] –](/img/tmb/12/1131179/f978f505c94b7d0e43ed415b4a3185b9-720x.jpg)
![Лиганд Донорный атом OOH- - гидроксо-лигандO2- - оксо-лигандO22- - пероксо-лигандK2[Zn(OH)4] – тетрагидроксоцинкат(II) калияЭлекторонейтральные](/img/tmb/12/1131179/6de6f876ef0cb7e0e9036e4d1aa848dc-720x.jpg)

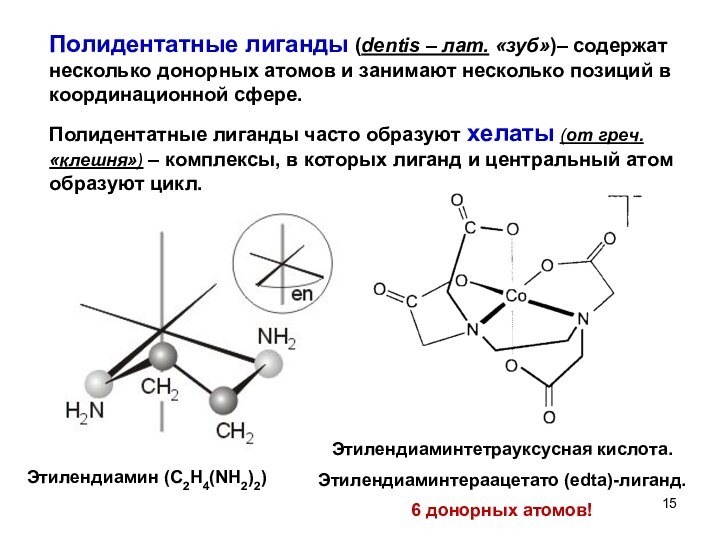

![Лиганд Изомерия КС Геометрическая изомерияЦис-и транс- изомеры, дляквадратных частиц.[Pt(Gly)2] – диглицинатоплатина (II)Транс –](/img/tmb/12/1131179/9fa87554bed057453e996f42901a0847-720x.jpg)
![Лиганд Геометрическая изомерияос- (mer-) реберный гран- (fac-) граневойДля октаэдрических частиц[Pt(NH3)2Cl4][Co(NH3)3Cl3]транс- (trans-) цис- (cis-)](/img/tmb/12/1131179/0a2a00fd79ae4603065fcf1b5d427fe0-720x.jpg)
![Лиганд Ионизационная изомерияЛиганды во внутренней и внешней координационной сфере меняются местами.[Co(NH3)5Cl]CN – пентаамминхлорокобальт](/img/tmb/12/1131179/ad4f3a4b86c5e29afd68098fd792150e-720x.jpg)



![Лиганд Координационная полимерия связана с изменение молекулярной массы комплексного соединения(PtCl2(NH3)2)n[Pt(NH3)2Cl2] – один атом](/img/tmb/12/1131179/3b4f3246a814d06709e511e313569f03-720x.jpg)

![Лиганд ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА КОМПЛЕКСОВCd2+ + CN- = [Cd(CN)+]](/img/tmb/12/1131179/3080fe3835d14613a87f0793e8a87408-720x.jpg)

![Лиганд ХЕЛАТНЫЙ ЭФФЕКТ Большая устойчивость хелатных комплексов по сравнению с их нехелатными аналогами.[Ni(H2O)6]2+](/img/tmb/12/1131179/40fe5fd124c396ffebb49e7827fd95d9-720x.jpg)





























